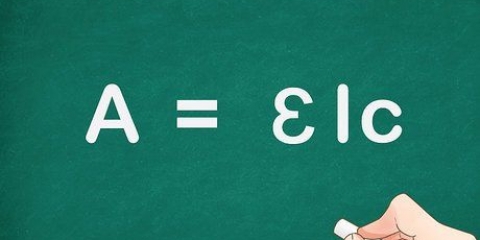Eksempel på opgave: Mol = 0,75 mol NaCl Volumen = 4,2 L 
Eksempel på problem: molaritet = 0,75 mol / 4.2L = 0,17857142 
Eksempel på opgave: 0,179 M NaCl 

Eksempel på opgave: Masse = 3,4 g KMnO4 Volumen = 5,2 L 
Eksempel på opgave: Molmassen af K = 39,1 g Den molære masse af Mn = 54,9 g Den molære masse af O = 16,0 g Total molær masse = K + Mn + O + O + O + O = 39,1 + 54.9 + 16 + 16 + 16 + 16 = 158,0 gram 
Eksempel på problem: gram stof * (1/molær masse af stoffet) = 3,4 g * (1 mol / 158 g) = 0,0215 mol 
Eksempel på problem: molaritet = 0,0215 mol / 5.2L = 0.004134615 
Eksempel på opgave: 0,004 M KMnO4 

Eksempel på opgave: Antal mol = 1,2 mol CaCl2 Volumen = 2905 ml 
Eksempeludsagn: 2905 ml * (1 L / 1000 ml) = 2905 L 
Eksempelopgave: 1,2 mol CaCl2 / 2905L = 0,413080895 
Eksempel på opgave: 0,413 M CaCl2 

Den molære masse af Na = 22,99 g Den molære masse af Cl = 35,45 g Den molære masse af NaCl = 22,99 + 35.45 = 58,44 gram 
Mol NaCl = 5,2 g NaCl * (1 mol / 58,44 g) = 0,08898 mol = 0,09 mol 
Du kan også se dette som at gange 800 ml med en konverteringsfaktor på 1 L / 1000 ml. For at gøre dette hurtigt, skal du blot flytte decimaltegnet 3 cifre til venstre i stedet for at beregne dette. Volumen = 800 ml * (1 L / 1000 ml) = 800 ml / 1000 ml = 0,8 L 
Molaritet = antal mol stof / antal liter opløsning = 0,09 mol / 0,8 L = 0,1125 mol/L 
Svar: 0,11 M NaCl
Beregning af molariteten af en opløsning
Indhold
Molaritet er en beskrivelse af forholdet mellem antallet af mol af en væske og dens volumen. For at beregne molaritet starter du med mol og volumen, masse og volumen eller mol og milliliter. Disse variabler udfyldes derefter i standard molaritetsberegningsformlen for (forhåbentlig) at få det rigtige svar.
Trin
Metode 1 af 4: Beregning af molaritet ved hjælp af mol og volumen

1. Lær standardformlen til beregning af molaritet. Molaritet er lig med antallet af mol af et opløst stof divideret med opløsningens volumen i liter. Dette er allerede skrevet: molaritet = antal mol stof / antal liter opløsning
- Eksempelopgave: Hvad er molariteten af en opløsning af 0,75 mol NaCl i 4,2 liter vand?

2. Se opgaven. Beregning af molaritet kræver et vist antal mol stof og antal liter opløsning. Hvis opgørelsen indeholder disse tal, skal der ikke udføres noget forberedende arbejde.

3. Divider antallet af mol med antallet af liter. Den fraktion, du får, giver så antallet af mol pr. liter opløsning, også kendt som molariteten.

4. Skriv dit svar. Udfyld svaret korrekt afhængigt af dine måledata og kravene til problemet. Kort ordet "molaritet" af med "m" og brug det opløste stofs kemiske navn.
Metode 2 af 4: Beregning af molaritet med masse og volumen

1. Du kender standardformlen til beregning af molaritet.molaritet = antal mol stof / antal liter opløsning
- Eksempel på problem: Hvad er molariteten af en opløsning ved at opløse 3,4 g KMnO4 i 5,2 liter eller vand?

2. Se opgaven. Beregning af molaritet kræver et vist antal mol stof og antal liter opløsning. Hvis opgørelsen ikke giver disse tal, skal der laves noget forarbejde, før du kan fortsætte.

3. Bestem molmassen af det opløste stof. For at finde mol af det opløste stof er det nødvendigt først at beregne molmassen. Det gør du ved at lægge de forskellige molære masser af hvert grundstof i stoffet sammen. Denne molære masse kan findes ved at bruge det periodiske system.

4. Konverter gram til mol. Nu hvor du kender molmassen af det opløste stof, er det stadig nødvendigt at omregne dette til antallet af mol. Det gør du ved at bestemme, hvad 1 mol af stoffet vejer, og derefter gange dette med molmassen.

5. Divider antallet af mol med antallet af liter opløsning for at finde molariteten.

6. Skriv dit svar. Udfyld svaret korrekt afhængigt af dine måledata og kravene til problemet. Kort ordet "molaritet" af med "m" og brug det opløste stofs kemiske navn.
Metode 3 af 4: Beregning af molaritet ved hjælp af mol og milliliter

1. Du kender standardformlen til beregning af molaritet.molaritet = antal mol stof / antal liter opløsning. Hvis volumen er angivet i milliliter, skal du konvertere den.
- Eksempelproblem: Hvad er molariteten af en opløsning af 1,2 mol CaCl2 i 2905 milliliter vand?

2. Se opgaven. Beregning af molaritet kræver et vist antal mol stof og antal liter opløsning. Hvis opgørelsen ikke giver disse tal, skal der laves noget forarbejde, før du kan fortsætte.

3. Omregn antallet af milliliter til liter. Find antallet af liter af opløsningen ved at dividere rumfanget med 1000 eller flytte decimaltegnet 3 cifre til venstre.

4. Divider antallet af mol med antallet af liter. Nu hvor du har alle tallene i en række kan du beregne molariteten af opløsningen.

5. Skriv dit svar. Udfyld svaret korrekt afhængigt af dine måledata og kravene til problemet. Kort ordet "molaritet" af med "m" og brug det opløste stofs kemiske navn.
Metode 4 af 4: Ekstra øvelsesproblem

1. Vi ønsker at bestemme molariteten af en opløsning af 5,2 g NaCl i 800 ml vand. List først disse værdier for klarhed: masse i gram og volumen i milliliter.
- Masse = 5,2 g NaCl
- Volumen = 800 ml vand

2. Bestem den molære masse af NaCl. Det gør du ved at tilføje den molære masse af natrium (Na) og den molære masse af klor (Cl).

3. Gang massen af stoffet med omregningsfaktoren for den molære masse. I dette eksempel er den molære masse af NaCl 58.44 g, så du har 1 mol / 58,44 g.

4. Divider 800 ml vand med 1000 for at få antallet af liter.

5. Del mol af et stof med liter af opløsningen. For at finde molariteten divideres 0,09 mol af stoffet NaCl med 0,8 L af opløsningen.

6. Gør dit svar pænere. Afrund dit svar til to eller tre decimaler og forkort molaritet til "M.”
Artikler om emnet "Beregning af molariteten af en opløsning"
Оцените, пожалуйста статью
Lignende
Populær