Så molmassen af et grundstof er lig med molmassen af et atom gange antallet af atomer i hvert molekyle: for brint, 1,008 gange 2 eller 2,016 gram pr. mol; oxygen, 15,9994 gange 2 eller 31,9988 gram pr. mol; og for klor 35.453 gange 2 eller 70.096 gram pr. mol. 

Den molære masse af hvert element af hydrogenchlorid, HCl, er 1,008 gram pr. mol brint og 35,453 gram pr. mol klor. Den molære masse af hvert element af glukose, C6huh12O6, er 12,0107 gange 6 eller 72,0642 gram pr. mol carbon; 1,008 gange 12 eller 12,096 gram pr. mol hydrogen; og 15,9994 gange 6 eller 95,9964 gram pr. mol ilt. 
Den molære masse af hydrogenchlorid er 1,008 + 35,453 eller 36,461 gram pr. Den molære masse af glucose er 72,0642 + 12,096 + 95,9964 eller 180,1566 gram pr.
Beregning af molær masse
Indhold
Atomer er for små til meningsfulde målinger af kemikalier. For at kunne arbejde med meget små mængder af et bestemt stof, klassificeres disse af videnskabsmænd i enheder af mol. En mol er defineret som en vis mængde stof med lige så mange partikler som antallet af kulstofatomer i 12 gram af C-12 isotopen, hvilket groft svarer til 6,022 14 × 10. Dette kaldes Avogadro .s tal eller konstant. Det bruges til at angive antallet af atomer, molekyler, ioner eller subatomære partikler i ethvert stof, og massen af 1 mol er den molære masse af det pågældende stof. Her kan du læse, hvordan du beregner grundstoffers og stoffers molære masse.
Trin
Metode 1 af 2: Beregning af molmassen af et grundstof

1. Find grundstoffets relative atommasse. Et grundstofs relative atommasse er det vægtede gennemsnit, udtrykt i atommasseenheder (u), af atommasserne af alle naturligt forekommende isotoper.Du kan finde disse oplysninger i det periodiske system. Som et eksempel har brint en relativ atommasse på 1,008; carbon 12,0107; oxygen 15,9994; og chlor 35.453.

2. Gang med molmassen. Dette er defineret som 1 gram pr. mol. Dette konverterer atommasseenheden til gram pr. mol, hvilket gør den molære masse af brint lig med 1,008 gram pr. mol, kulstof 12,0107 gram pr. mol, oxygen 15,9994 gram pr. mol og klor 35,453 gram pr.
3. Find molmassen af et divalent molekyle. Nogle grundstoffer kan kun findes i molekyler på 2 eller flere. Det betyder, at hvis du vil beregne molmassen af et grundstof, der består af f.eks. 2 atomer, såsom brint, oxygen og klor, skal du bestemme den relative atommasse og gange den med molmassen, og gange resultatet med 2.
Metode 2 af 2: Beregning af molmassen af en forbindelse

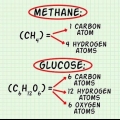
1. Bestem den kemiske formel for forbindelsen. Dette er antallet af atomer i hvert element i forbindelsen. (Oplysninger om dette kan findes i f.eks. Binas) For eksempel: formlen for hydrogenchlorid (saltsyre) er HCl; for glucose C6huh12O6. Den sidste formel betyder, at glucose indeholder 6 carbonatomer, 12 hydrogenatomer og 6 oxygenatomer.

2. Bestem den molære masse af hvert grundstof i forbindelsen. Multiplicer grundstoffets atommasse med molmassen og antallet af atomer af grundstoffet i forbindelsen. Sådan fungerer det:

3. Tilføj de molære masser af hvert grundstof i forbindelsen. Dette giver den molære masse af forbindelsen. Sådan gør du det:
Tips
- Mens relative atommasser i de fleste tilfælde har en nøjagtighed på 4 decimaler, er en nøjagtighed på 2 decimaler eller mindre sand i laboratoriet for usædvanligt store masser. Så i laboratoriet er den molære masse af hydrogenchlorid 36,46 gram pr. mol, og den for glucose er 180,16 gram pr. mol.
Advarsler
- Forveksle ikke molær masse og molekylær masse. Sidstnævnte er massen af et individuelt molekyle af et grundstof eller en forbindelse. Molmasse kan forstås som gennemsnitsmassen af alle molekyler i en prøve af et givet stof, ligesom den relative atommasse er gennemsnittet af atommasserne af alle isotoper.
Fornødenheder
- Binas og grundstoffernes periodiske system
- Lommeregner
Artikler om emnet "Beregning af molær masse"
Оцените, пожалуйста статью
Populær