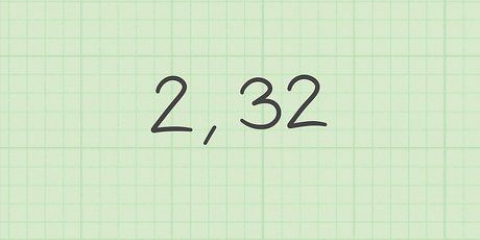For eksempel i NaCl (natriumchlorid) molekylet har chloratomet en ret høj elektronegativitet og natrium en ret lav elektronegativitet. Som et resultat vil elektronerne blive trukket mod klor og væk fra natrium. 
Det her er et link til en fremragende elektronegativitetstabel. Bemærk, at dette repræsenterer elektronegativitet i henhold til Pauling-skalaen, den mest almindeligt anvendte skala. Der er dog andre måder at måle elektronegativitet på, hvoraf den ene vil blive vist nedenfor. 
Et atoms elektronegativitet er højere hvis du går ret bevæger sig i det periodiske system. Et atoms elektronegativitet er højere hvis du op flytter sig i det periodiske system. Atomerne øverst til højre har den højeste elektronegativitet og atomerne nederst til venstre den laveste. For eksempel, i eksemplet ovenfor med NaCl, ved du, at klor har en højere elektronegativitet end natrium, fordi det næsten er øverst til højre i systemet. På den anden side er natrium langt til venstre, hvilket gør det til et atom med lavere værdi. 

For eksempel: molekylet O2 har en sådan type binding. Da de to oxygenatomer har samme elektronegativitet, er forskellen mellem dem 0. 
Et godt eksempel på dette er molekylet H2O (vand). O`et er mere elektronegativt end de to H`er, hvilket får det til at binde elektronerne tættere, hvilket gør hele molekylet delvist negativt ved O-atomet og delvist positivt ved H-atomerne. 
Et eksempel på dette er NaCl (natriumchlorid). Klor er så elektronegativt, at det tiltrækker begge elektroner i bindingen hele vejen mod sig selv, hvilket giver natrium en positiv ladning. 
De fleste atomer til venstre og i midten af det periodiske system er atomer. Denne siden har en tabel, der angiver, hvilke elementer der er metaller. Det tidligere nævnte HF-eksempel falder ind under denne kategori. Da H og F ikke er metaller, har de en polær kovalent bånd. 

Elektronaffiniteten af y eller lithium er 60 KJ mol. 
I vores eksempel løser vi dette på denne måde:
Beregning af elektronegativitet
Indhold
I kemi er elektronegativitet et mål for den kraft, hvormed et atom tiltrækker elektronerne i en atombinding. Et atom med høj elektronegativitet tiltrækker elektroner stærkere, mens et atom med lav elektronegativitet tiltrækker dem svagt. Elektronegative værdier bruges til at forudsige, hvordan forskellige atomer vil opføre sig i en binding, hvilket gør dette til en vigtig færdighed for grundlæggende kemi.
Trin
Metode 1 af 3: Grundlæggende om elektronegativitet

1. Forstå, at kemiske bindinger dannes, når atomer deler elektroner. For at forstå elektronegativitet er det vigtigt først at forstå, hvad en `binding` er. Alle atomer i et molekyle, der er `bundet` til hinanden i et molekylært diagram, har en atombinding. Grundlæggende betyder dette, at de deler to elektroner - hvert atom bidrager med en elektron til bindingen.
- Det eksakt grunde til, at atomer deler elektroner og danner en binding, er lidt for langt for denne artikel. Hvis du vil vide mere om dette, så læs denne artikel om det grundlæggende i en atombinding, eller wikiHows egne artikler om emnet.

2. Forstå effekten af elektronegativitet på elektronerne i bindingen. Når to atomer deler to elektroner i en binding, deler de ikke lige meget. Når et atom har en højere elektronegativitet end atomet bundet til, trækker det de to elektroner i bindingen tættere på sig selv. Et atom med meget høj elektronegativitet kan trække elektronerne helt ud til sin side af bindingen, så elektronerne næsten ikke deles med det andet atom.

3. Brug en elektronegativitetstabel som reference. En elektronegativitetstabel af grundstoffer har grundstofferne arrangeret på samme måde som i et periodisk system, undtagen i dette tilfælde er hvert atom mærket med dets elektronegativitet. Du kan finde disse i mange lærebøger og tekniske artikler, men også online.

4. Husk, at elektronegativitet egner sig til hurtige skøn. Hvis du ikke har en elektronegativitetstabel ved hånden, kan du stadig estimere et atoms elektronegativitet baseret på, hvor det er i det periodiske system. Som en generel regel:
Metode 2 af 3: Find bindinger med elektronegativitet

1. Find forskellen i elektronegativitet mellem de to atomer. Når to atomer danner en binding, kan forskellen i deres elektronegativitet fortælle dig mere om kvaliteten af deres binding. Træk den mindre elektronegativitet fra den større for at finde forskellen.
- For eksempel, hvis vi ser på molekylet HF, trækker vi elektronegativiteten af hydrogen (2.1) fra fluor (4.0). 4,0 - 2.1=1.9

2. Hvis forskellen er mindre end 0,5, så er bindingen apolær kovalent. Elektronerne deles næsten fuldstændig ligeligt. Disse bindinger danner ikke molekyler med store ladningsforskelle på begge sider. Ikke-polære bindinger er ofte meget svære at bryde.

3. Hvis forskellen er mellem 0,5-1,6, så er bindingen polær kovalent. Disse bindinger har flere elektroner i den ene ende end i den anden. Dette gør molekylet lidt mere negativt på siden med elektronerne og lidt mere positivt på siden uden elektroner. Ladningsubalancen i disse bindinger gør det muligt for molekylet at deltage i visse specielle reaktioner.

4. Hvis forskellen er mere end 2,0, er bindingen ionisk. I disse bindinger er elektronerne helt i den ene ende af bindingen. Det mere elektronegative atom får negativ ladning, og det mindre elektronegative atom får mere positiv ladning. Disse typer bindinger gør det muligt for de tilknyttede atomer at reagere godt med andre atomer og endda blive trukket fra hinanden af polære atomer.

5. Hvis forskellen er mellem 1,6-2,0, skal du kontrollere, om der er metal til stede. Hvis der godt et metal er til stede i bindingen, så er bindingen ionisk. Hvis der kun er ikke-metaller i det, så er bindingen polær kovalent
Metode 3 af 3: Bestem Mulliken-elektronegativiteten

1. Find den første ioniseringsenergi af atomet. Mulliken elektronegativitet er en lidt anderledes måde at måle elektronegativitet på end den, der bruges i Pauling-tabellen ovenfor. For at finde Mulliken elektronegativiteten af et bestemt atom, skal du først finde ioniseringsenergien af det atom. Dette er den energi, der kræves for at få atomet til at aflade en enkelt elektron.
- Dette er noget, du sandsynligvis bliver nødt til at slå op i kemi-opslagsbøger. Denne webstedet har en god tabel, du kan bruge (rul ned for at finde den).
- Et eksempel: Antag, at vi ønsker at bestemme elektronegativiteten af lithium (Li). I tabellen på ovenstående side kan vi læse, at den første ioniseringsenergi er lig med 520 kJ/mol.

2. Find atomets elektronaffinitet. Dette er et mål for den energi, der opnås, når en elektron føjes til et atom for at skabe en negativ ion. Igen, det er noget, du bliver nødt til at slå op i en opslagsbog. Denne webstedet har ressourcer, du måske ønsker at tjekke ud.

3. Løs Mulliken-elektronegativiteten med ligningen. Ved at bruge kJ/mol som en enhed for energi, er ligningen for Mulliken elektronegativitet lig med OGMulliken=(1,97×10)(Ejeg+Eea) + 0,19. Inkorporer dine værdier i ligningen og løs for OGMulliken.
- OGMulliken=(1,97×10)(Ejeg+Eea) + 0,19
- OGMulliken=(1,97×10)(520 + 60) + 0,19
- OGMulliken=1,143 + 0,19=1.333
Tips
- Ud over Pauling- og Mulliken-skalaerne er der andre elektronegativitetsskalaer, herunder Allred-Rochow, Sanderson og Allen. Disse har alle deres egne ligninger til beregning af elektronegativitet (hvoraf nogle kan blive ret komplekse).
- Elektronegativitet har ingen enheder.
Artikler om emnet "Beregning af elektronegativitet"
Оцените, пожалуйста статью
Lignende
Populær