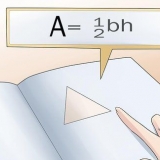
For eksempel: For eksempel har isotopen Ag-107 (sølv) en atommasse på 106.90509 amuse (atommasseenhed). Isotopen Ag-109 er lidt tungere med en masse på 108,90470. De sidste par decimaler kan være lidt forskellige afhængigt af kilden. Indsæt ikke tal i parentes efter messen. 
Isotopen Ag-107 har en procentdel på 5,86 %. AG-109 er lidt mindre almindelig med en hastighed på 48,14 %. Det betyder, at en specifik mængde sølv indeholder 51,86 % Ag-107 og 48,14 % Ag-109. Ignorer alle isotoper uden at angive procentdelen. Disse isotoper forekommer ikke naturligt på Jorden. 
I eksemplet er procenterne: 51,86 / 100 = 0,5186 og 48,14 / 100 = 0,4814. 
Gennemsnitlig atommasseAg = (masseAg-107 * procentAg-107) + (masseAg-109 * procentAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. Slå elementet op i det periodiske system for at kontrollere dit svar. Den gennemsnitlige atommasse er normalt skrevet under grundstofsymbolet. 


Et vandmolekyle har den kemiske formel H2O, og indeholder således to hydrogenatomer (H) og et oxygenatom (O). Brint har en gennemsnitlig atommasse på 1,00794 amu. Iltatomer har en gennemsnitlig masse på 15,9994 amu. Den gennemsnitlige masse af et molekyle af H2O er lig med (1,00794)(2) + 15,9994 = 18,01528 amu, svarende til 18,01528 g/mol.
Beregning af den gennemsnitlige atommasse
Indhold
Gennemsnitlig atommasse er ikke en direkte måling af et enkelt atom. I stedet er det den gennemsnitlige masse pr. atom af en bestemt mængde af et givet grundstof. Hvis du kan måle massen af milliarder af individuelle atomer, kan du beregne denne værdi på samme måde som gennemsnittet. Heldigvis er der en mere praktisk metode, der er afhængig af observeret information om sjældenheden af forskellige isotoper.
Trin
Del 1 af 2: Beregning af den gennemsnitlige atommasse

1. Forstå isotoper og atommasser. De fleste grundstoffer forekommer naturligt i flere former eller isotoper. Den eneste forskel mellem to isotoper af samme grundstof er antallet af neutroner pr. atom og dermed atommassen. Den gennemsnitlige atommasse af et grundstof tager højde for disse variationer og giver dig den gennemsnitlige masse pr. atom i en given mængde af dette grundstof.
- For eksempel har grundstoffet sølv (Ag) to naturligt forekommende isotoper: Ag-107 og Ag-109 (eller Ag og Ag). Isotoper er opkaldt efter "massetallet" eller summen af protoner og neutroner i et atom. Det betyder, at Ag-109 har to ekstra neutroner pr. atom sammenlignet med Ag-107, og derfor lidt mere masse.

2. Find massen af hver isotop. Du skal bruge to typer oplysninger for hver isotop, som du kan slå op i en opslagsbog eller en online ressource, som f.eks web elementer.com. Den første er atommassen eller massen af et atom af en hvilken som helst isotop. Isotoper med flere neutroner har mere masse.

3. Skriv ned mængden af hver isotop. Dette mål fortæller dig, hvor almindelig isotopen er (som en procentdel af alle grundstoffets atomer). Du kan finde dette i den samme kilde, hvor du fandt masserne. Antallet af isotoper skal lægges op til 100 % (selvom det kan være lidt forskudt på grund af afrundingsfejl).

4. Konverter procenter til decimaler. Divider procentdelen af en isotop med 100 for decimalværdien.

5. Bestem det vægtede gennemsnit af masserne. Den gennemsnitlige atommasse af et grundstof med n isotoper lig med (masseisotop 1 * procentisotop 1) + (masseisotop 2 * procentisotop 2) + ... + (masseisotop n * procentisotop n. Dette er et eksempel på et "vægtet gennemsnit", hvilket betyder, at de mere almindelige (mere rigelige) masser har en større effekt på resultatet. Sådan bruger du denne formel til sølv:
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu.
Del 2 af 2: Brug af resultatet

1. Konverter masse til antal atomer. Den gennemsnitlige atommasse fortæller dig forholdet mellem massen og antallet af atomer i en bestemt mængde af grundstoffet. Dette er nyttigt i eksperimentel kemi, da det er næsten umuligt at tælle individuelle atomer, men let at måle masse. For eksempel kan du veje en prøve af sølv og forudsige, at hver masse på 107,8677 amu indeholder et sølvatom.

2. Konverter til molær masse. Atommasseenheder er meget små, så kemikere vejer normalt mængder af atomer i gram. Heldigvis er disse udtryk blevet defineret for at gøre konverteringen så nem som muligt. Du behøver kun at gange den gennemsnitlige atommasse med 1 g/mol (molmassekonstanten) for et svar i g/mol. For eksempel indeholder 107,8677 gram sølv i gennemsnit et mol sølvatomer.

3. Bestem den gennemsnitlige molekylmasse. Da et molekyle simpelthen er en samling af atomer, kan du lægge atomernes masser sammen for at bestemme molekylets masse. Hvis du bruger den gennemsnitlige atommasse (i stedet for massen af en bestemt isotop), er svaret den gennemsnitlige molekylmasse som fundet i en naturligt forekommende mængde. Her er et eksempel:
Tips
- Udtrykket relativ atommasse bruges nogle gange som et synonym for gennemsnitlig atommasse. Der er dog en lille forskel, da den relative atommasse ikke har nogen enheder; det er et mål for massen i forhold til C-12 carbonatomet. Men så længe du bruger atommasseenheder i din gennemsnitlige masseberegning, er de to værdier numerisk identiske.
- Tallet i parentes efter en atommasse er usikkerheden på det endelige tal. For eksempel: En atommasse på 1,0173(4) betyder, at typiske prøver har en fejlmargin på ±0,0004. Du behøver ikke tage højde for dette, medmindre problemet kræver det.
- Med sjældne undtagelser har grundstoffer længere nede i det periodiske system en højere gennemsnitlig masse end grundstofferne før dem. Dette er en hurtig måde at kontrollere, om dine svar giver mening.
- 1 atommasseenhed er defineret som 1/12 af massen af et C-12 carbonatom.
- Forekomsten af isotoper er baseret på prøver, der forekommer naturligt på Jorden. Usædvanlige stoffer, såsom en meteorit eller en prøve lavet i et laboratorium, kan have forskellige isotopforhold og dermed en anden gennemsnitlig atommasse.
Advarsler
- Atommasser er næsten altid repræsenteret som en atommasseenhed (amu eller u) (også kaldet Dalton eller Da). Sæt aldrig en anden masseenhed (såsom kg) efter et tal uden at konvertere det.
Fornødenheder
- Blyant
- Papir
- Lommeregner
- Procentandele af isotoper
- Atommasseenheder af isotoper
Artikler om emnet "Beregning af den gennemsnitlige atommasse"
Оцените, пожалуйста статью
Populær