Fordi atomer er ekstraordinært små, arbejder videnskabsmænd normalt med atomer i større mængder kaldet mølle. En muldvarp er mængden af et stof med lige så mange atomer, som der ville være i 12 gram af isotopen kulstof-12. Dette tal er omkring 600 billioner (6 gange 10 til 23. potens) af atomer, og er kendt som Avogadros konstant, efter videnskabsmanden, der definerede det. 


En opslagsbog vil give forhold baseret på alle kendte mængder af isotoper af et grundstof, mens massespektrometeret vil give forholdet for prøven, der testes. 
I eksemplet ovenfor: 12 x 0,99 = 11,88 for kulstof-12 og 13 x 0,01 = 0,13 for kulstof-13. Den relative atommasse er 11,88 + 0,13 = 12,01. (På grund af forholdet mellem isotoper er de relative atommasser på de periodiske systemer sjældent hele tal.)
Beregn atommasse
Indhold
Atommasse er massen af en specifik isotop af et givet atom, men det bruges også forkert til at beskrive gennemsnitsvægten af en prøve af forskellige isotoper af det samme grundstof, som faktisk kaldes relativ atommasse eller atomvægt. Uanset hvilken værdi du leder efter, viser vi dig trinene til at beregne atommasse og relativ atommasse.
Trin
Metode 1 af 2: Beregn atommasse

1. Find grundstoffets eller isotopens atomnummer. Atomnummeret er antallet af protoner i et grundstof, og det ændrer sig aldrig. For eksempel: alle brintatomer, kun og kun brintatomer, har én proton. Kulstof har atomnummer 6, fordi dets kerne har seks protoner, mens oxygen har atomnummer 8, fordi dets kerne har otte protoner.

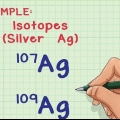
2. Bestem antallet af neutroner i kernen. Antallet af neutroner kan variere inden for et atom - selvom de er det samme grundstof, er der forskellige isotoper af det grundstof. To isotoper af samme grundstof vil have det samme antal protoner, men et forskelligt antal neutroner.

3. Ignorer antallet af elektroner, der kredser om kernen. Massen af elektroner i et atom er ubetydelig sammenlignet med protonerne og neutronerne i kernen.

4. Tilføj antallet af protoner og neutroner. Dette er atommassen af det atom.
Metode 2 af 2: Beregn relativ atommasse (atomvægt)

1. Bestem antallet af isotoper i prøven. Hvilke isotoper der er i prøven kan bestemmes ved at bruge et massespektrometer.

2. Bestem den relative mængde af hver isotop i prøven. Denne information kan fås ved massespektrometri eller fra en opslagsbog.

3. Multiplicer atommassen af hver isotop med dens forhold i prøven. I en prøve, der indeholder kulstof-12 og kulstof-13, hvis 99 procent af prøven er kulstof-12, ganges 12 med 0,99 og 13 med 0,01.

4. Læg resultaterne sammen. Summen er den relative atommasse eller atomvægt af prøven.
Tips
- Nogle isotoper er mindre stabile end andre og nedbrydes til grundstoffer med færre protoner og neutroner i deres kerner, mens de frastøder dele af sig selv. Disse isotoper kaldes radioaktive.
Fornødenheder
- Massespektrometer
- Kemisk opslagsbog
- Lommeregner
Artikler om emnet "Beregn atommasse"
Оцените, пожалуйста статью
Populær