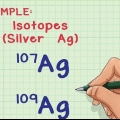
For kuldioxid (CO2) den relative atommasse er 12.011 amu for kulstof og 15.999 for oxygen. Atommassen af et grundstof er omtrent lig med summen af massen af antallet af protoner og neutroner, det indeholder. Bemærk, at den relative atommasse, du finder i det periodiske system, er skaleret: den tager højde for alle isotoper af grundstoffet i proportionerne, som de forekommer naturligt. 
I vores kuldioxid-eksempel er massen af kulstofatomet 12.011 amu. Da der er to iltatomer, skriv dette som  .
. 
Afrund svaret hvor det er nødvendigt, ved hjælp af væsentlige tal. Glem ikke at bruge de rigtige enheder. amu er den gamle forkortelse for atomic masse unit, men en bedre, moderne enhed er en lille skrevet du. For kuldioxid kan molekylmassen findes som følger:  .
. 





Beregning af molekylær masse
Molekylær masse, tidligere kaldet molekylvægt (MW), er massen af alle atomer i en given molekylær formel.Molekylmasse måles i atomare masseenheder, normalt udtrykt i du eller underholde. For at beregne molekylmassen af en formel skal du lægge atommasserne for hvert tilstedeværende grundstof sammen.
Trin
Metode 1 af 2: Beregning af molekylmassen

1. Tæl hvor mange atomer af hvert grundstof der er i molekylet. Først skal du liste hvert element, der er til stede i molekylet. Du kan bruge det kemiske symbol eller skrive navnet på grundstoffet. Tæl derefter atomerne efter molekylformlen og skriv dem ud for grundstoffets navn eller symbol.
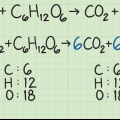
- For eksempel: kuldioxid eller CO2, indeholder 1 kulstof (C) og 2 oxygen (O).
- Methan, CH4, indeholder kulstof (C) og brint (H). Metan består af 1 carbonatom og 4 hydrogenatomer.
- glukose, CO6huh12O6, indeholder kulstof (C), brint (H) og oxygen (O). Glukose består af 6 carbonatomer, 12 hydrogenatomer og 6 oxygenatomer.

2. Særligrelativ atommasse af hvert element i molekylet. Brug det periodiske system. Det periodiske system viser atommassen af hvert grundstof under det kemiske symbol. For eksempel: oxygen har en relativ atommasse på 15,9994 amu.

3. Beregn den samlede masse af hvert grundstof i molekylet. Multiplicer atommassen af hvert grundstof med antallet af atomer i det pågældende grundstof: (grundstofs atommasse) x (antal atomer af det pågældende grundstof). Gør dette for hvert element i molekylet.
 .
.
4. Læg masserne af alle atomer sammen for at finde molekylmassen. Molekylmasse = ∑((grundstoffets atommasse)n x (antal atomer af det element)n)
 .
.Metode 2 af 2: Øv med eksempler

1. Bestem molekylmassen af metan (CH4). Atommassen af brint er 1,008 u. Atommassen af kulstof er 12.011 u. Der er fire brintatomer i metan. Læg vægten af alle atomer i metan sammen for at finde molekylmassen.
.

2. Beregn molekylmassen af glucose (C6huh12O6). Atommassen af kulstof er 12.011 u. Atommassen af brint er 1,008 u. Atommassen af oxygen er 15.999. Der er 6 carbonatomer, 12 hydrogenatomer og 6 oxygenatomer. Læg masserne af alle atomerne i glucose sammen for at beregne molekylmassen.




Tips
- Sørg for at følge de korrekte regler for væsentlige tal efter behov.
Artikler om emnet "Beregning af molekylær masse"
Оцените, пожалуйста статью
Populær