I denne formel, n antallet af mol, s presset, V lydstyrken, t temperaturen i Kelvin og R gaskonstanten. Eksempel: n=PV/RT=(0,984 atm x 1 L) / (0,08206 L atm mol-1 K-1 x 318,15 K)=0,0377 mol 
Eksempel: 14,42 g / 0,0377 mol=382,49 g/mol 
Eksempel: (12,0107g x 12) + (15,9994g x 1) + (1,00794g x 30)=144,1284 + 15,9994 + 30,2382=190,366g 
Eksempel: 382,49 / 190,366=2,009 
Eksempel: C12OH30 x 2=C24O2H60 

Eksempel: 75,46 g C x (1 mol / 12,0107 g) = 6,28 mol C 8,43 g O x (1 mol / 15,9994 g) = 0,53 mol O 16,11 g H x (1 mol / 1,00794) = 15,98 mol H 
Eksempel: Den mindste molære mængde er oxygen med 0,53 mol. 6,28 mol/0,53 mol=11,83 0,53 mol/0,53 mol=1 15,98 mol/0,53 mol=30,15 
Eksempel: forholdsformlen bliver så C12OH30 11,83=12 1=1 30,15=30 


Bestemmelse af et stofs molekylære formel
Indhold
Den molekylære formel er en vigtig information om et kemikalie. Molekylformlen angiver, hvilke atomer der er til stede i stoffet og hvor mange af hver. Du skal bruge forholdsformlen for at beregne molekylformlen, og du skal også vide, at forskellen mellem disse to formler er et heltal.
Trin
Del 1 af 3: Udledning af molekylformlen fra en forholdsformel

1. Kend sammenhængen mellem molekylformlen og forholdsformlen. Forholdsformlen siger noget om forholdet mellem atomer i et molekyle, for eksempel to oxygenatomer på hvert kulstofatom. Molekylformlen fortæller dig, hvor meget af hvert af disse atomer er til stede i molekylet. For eksempel et kulstof og to oxygenatomer (kuldioxid). Disse to formler relaterer sig til hinanden med et heltal på en sådan måde, at hvis forholdsformlen ganges med dette forhold, vil molekylformlen komme ud.

2. Beregn antallet af mol gas. Det betyder, at du bruger den ideelle gaslov. Du kan bestemme antallet af mol baseret på trykket, volumen og temperaturen som leveret af data fra eksperimenter. Antallet af mol kan beregnes med formlen: n=PV/RT.

3. Beregn gassens molekylmasse. Dette kan kun gøres, når antallet af mol til stede i gassen er kendt, ved at bruge den ideelle gaslov. Du skal også vide, hvor mange gram af en gas der er til stede. Derefter divideres antallet af gram gas med antallet af mol af gassen til stede, for at bestemme molekylmassen.

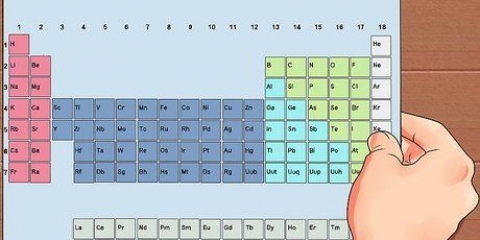
4. Læg atommasserne af alle atomer sammen i forholdsformlen. Hvert atom i forholdsformlen har sin egen atommasse. Denne værdi kan findes i bunden af elementets boks i det periodiske system. Læg disse masser sammen for at få massen af forholdsformlen.

5. Bestem forholdet mellem molekylmassen og forholdsformlens. Dette giver dig mulighed for at bestemme, hvor ofte massen går ind i det faktiske molekyle i henhold til forholdsformlen. Hvis du ved dette, så ved du også, hvor mange gange forholdsformlen går ind i molekylformlen. Dette skal være et heltal. Hvis forholdet ikke er et helt tal, så skal du afrunde det.

6. Gang forholdsformlen med forholdet. Multiplicer forholdsformlens sænkninger med forholdet. Dette vil give dig den molekylære formel. Bemærk, at for ethvert stof med forholdet `1` vil forholdsformlen og molekylformlen være den samme.
Del 2 af 3: Bestemmelse af forholdsformlen

1. Bestem massen af hvert tilstedeværende atom. Nogle gange vil massen af hvert atom blive givet. På et andet tidspunkt angives kun massen i procent. Hvis dette er tilfældet, antag, at det er en prøve på 100 g af stoffet. Hermed kan du skrive masseprocenten som faktisk masse i gram.
- Eksempel: 75,46 g C, 8,43 g O, 16,11 g H

2. Omregn masserne til antallet af mol. Du skal konvertere molekylmassen af hvert grundstof til mol. For at gøre dette skal du dividere molekylmassen med atommassen af hvert respektive grundstof. Du kan finde atommassen i bunden af det elements boks i det periodiske system.

3. Divider hver molær værdi med den mindste molære værdi. Du skal dividere mol af hvert enkelt grundstof med den mindste molære mængde af alle grundstofferne i forbindelsen. Det giver dig mulighed for at bestemme de enkleste molforhold. Dette er gyldigt, fordi det element, der er til stede i den mindste mængde, er sat til `1`, og det giver de respektive proportioner af de andre grundstoffer i forbindelsen.

4. Afrund de molære værdier til heltal. Disse tal bliver abonnenterne på forholdsformlen. Afrund til nærmeste hele tal. Efter at have bestemt disse tal, kan du skrive forholdsformlen ned.
Del 3 af 3: Forstå den kemiske formel

1. Forstå, hvordan en forholdsformel fungerer. En forholdsformel giver dig information om forholdet mellem et atom og et andet i et molekyle. Dette giver dig ingen information om, hvor mange atomer der præcist er til stede i molekylet. Forholdsformlen giver dig heller ikke nogen information om strukturen og bindingen af atomerne i et molekyle.

2. Ved, hvad en molekylær formel fortæller dig. Ligesom forholdsformlen giver molekylformlen dig ikke information om bindingen og strukturen af et molekyle. Men i modsætning til forholdsformlen giver molekylformlen dig information om, hvor meget af hvert atom der er til stede i molekylet. Forholdsformlen og molekylformlen relaterer sig til hinanden i henhold til et heltalsforhold.

3. Forstå strukturformler. Strukturformler giver endnu mere information end molekylære formler. Udover at angive antallet af atomer i et molekyle, giver strukturformler dig også information om molekylets bindinger og struktur. Denne information er afgørende for at forstå, hvordan molekylet vil reagere.
Tips
- Læs erklæringen (eller dataene) omhyggeligt.
Advarsler
- Forveksle ikke forholdsformlen og molekylformlen.
Fornødenheder
- Grundstoffernes periodiske system
- Lommeregner
- Blyant
- Papir
Artikler om emnet "Bestemmelse af et stofs molekylære formel"
Оцените, пожалуйста статью
Lignende
Populær