K Shell (indre): 2 elektroner maksimum. L Skal: maks. 8 elektroner. M Shell: 18 elektroner maksimum. N Shell: maksimalt 32 elektroner. O Shell: maksimalt 50 elektroner. P Skal (ydre): maksimalt 72 elektroner. 
Hvis valensskallen er fuld, så er elementet stabilt. Hvis valensskallen ikke er fuld, er grundstoffet reaktivt, hvilket betyder, at det kan danne en kemisk binding med et andet grundstofs atom. Hvert atom deler sine valenselektroner i et forsøg på at gøre valensskallen fuld. 

Hydrogen (H) og Helium (He) har begge 1 skal, mens Francium (Fr) har 7. Lanthaniderne og actiniderne er grupperet og opført under hovedtabellen. Alle lanthanider tilhører periode 6, gruppe 3, og alle actinider tilhører periode 7, gruppe 3. 
Gruppe 1: 1 valenselektron Gruppe 2: 2 valenselektroner Gruppe 13: 3 valenselektroner Gruppe 14: 4 valenselektroner Gruppe 15: 5 valenselektroner Gruppe 16: 6 valenselektroner Gruppe 17: 7 valenselektroner Gruppe 18: 8 valenselektroner – undtagen helium, som har 2 

Gruppe 3: 3 valenselektroner Gruppe 4: 2 til 4 valenselektroner Gruppe 5: 2 til 5 valenselektroner Gruppe 6: 2 til 6 valenselektroner Gruppe 7: 2 til 7 valenselektroner Gruppe 8: 2 eller 3 valenselektroner Gruppe 9: 2 eller 3 valenselektroner Gruppe 10: 2 eller 3 valenselektroner Gruppe 11: 1 eller 2 valenselektroner Gruppe 12: 2 valenselektroner
Bestemmelse af antallet af valenselektroner
Indhold
Valenselektroner er placeret i den yderste skal af et grundstof. Antallet af valenselektroner i et atom bestemmer, hvilken type kemisk binding dette grundstof kan danne. Den bedste måde at finde ud af antallet af valenselektroner på er at bruge grundstoffernes periodiske system.
Trin
Metode 1 af 3: Del 1: Forståelse af elektronskaller

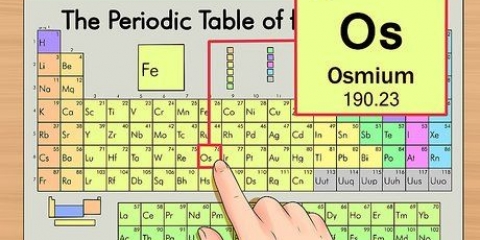
1. Grundstoffernes periodiske system. Dette er en tabel med farvekoder, hvor hver celle viser et grundstof med dets atomnummer og 1 til 3 bogstaver som symbol.

2. Find grundstoffets atomnummer. Atomnummeret er over eller ved siden af elementets symbol. For eksempel: Bor (B) har atomnummer 5, hvilket betyder, at det har 5 protoner og 5 elektroner.

3. Tegn en simpel gengivelse af et atom og placer elektronerne i kredsløb om kernen. Disse baner kaldes også skaller eller energiniveauer. Det maksimale antal elektroner, der kan være i samme skal, er fastsat, og skallerne fyldes fra den inderste til den yderste bane.

4. Find antallet af elektroner i den ydre skal. Disse er valenselektronerne.
Metode 2 af 3: Anden del: Find valenselektroner i metaller undtagen overgangsmetaller

1. Nummer hver kolonne i det periodiske system, fra 1 til 18. Hydrogen (H) er øverst i kolonne 1 og helium (He) er øverst i kolonne 18. Det er de forskellige grupper af elementer.

2. Nummer hver række fra 1 til 7. Disse er grundstoffernes perioder, og de svarer til antallet af skaller eller energiniveauer af et atom.

3. Find et element, der ikke er et overgangsmetal. Overgangsmetaller er i gruppe 3 til 12. Gruppenumrene på de andre metaller angiver antallet af valenselektroner.
Metode 3 af 3: Del tre: Find valenselektroner i overgangsmetaller

1. Find et grundstof fra gruppe 3 til 12, overgangsmetallerne.

2. Bestem antallet af valenselektroner baseret på gruppenummeret. Disse gruppenumre svarer til et muligt antal valenselektroner.
Tips
- Overgangsmetaller kan have valensskaller, der ikke er helt fyldte. Bestemmelse af det nøjagtige antal valenselektroner i overgangsmetaller kræver visse principper for kvanteteori, som ligger uden for denne artikels omfang.
Fornødenheder
- Grundstoffernes periodiske system
- Blyant
- Papir
Artikler om emnet "Bestemmelse af antallet af valenselektroner"
Оцените, пожалуйста статью
Lignende
Populær