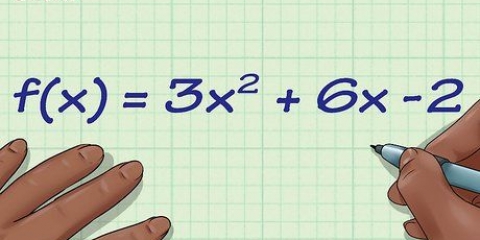Eksempel: Antag, at vi skal finde koncentrationen (i gram pr. liter) af en opløsning lavet ved at opløse 1/2 tsk salt i 2 liter vand. Vi ved også, at 1 tsk salt er omkring 6 gram. I dette tilfælde er konverteringen let - multiplicer: 1/2 tsk x (6 gram/1 tsk) = 3 gram salt. 3 gram salt divideret med 2 liter vand = 1.5 g/l Eksempel: Antag, at vi ønsker at finde molariteten af ovenstående saltopløsning. For at opsummere har vi 3 gram salt (NaCl) i 2 liter vand. Start med at finde ud af molmasserne af Na og Cl ved at kigge i det periodiske system. Na = ca. 23 g/mol og Cl = ca. 35,5 g/mol. Så MM af NaCl = 23 + 35,5 = 58,5 g/mol. 3 gram NaCl x (1 mol NaCl/58,5 g NaCl) = 0,051 mol NaCl. 0,051 mol NaCl / 2 liter vand = .026 M NaCl Hvad er molariteten af NaCL i en 400 ml opløsning, opnået ved at tilsætte 1.5 gram NaCl i vand? Hvad er koncentrationen, i ppm, af en opløsning fremstillet ved at tilsætte 0,001 g bly (Pb) til 150 l vand? (1 L vand = 1000 gram) I dette tilfælde vil volumenet af opløsningen stige med en lille smule ved at tilsætte stoffet, så du kan bruge opløsningsmidlets volumen som volumen af opløsningen. Find koncentrationen i gram pr. liter af en 0,1 L opløsning fremstillet ved at tilsætte 1/2 mol KCl til vand. Dette problem kræver, at du arbejder forfra og bagud ved at bruge molmassen af KCL til at beregne gram KCl i det opløste stof. Sørg for, at alt udstyr er forrenset, skyllet med deioniseret vand og tørt. Vær opmærksom: hvis reaktionen mellem opløsningen i buretten og det opløste stof i kolben ikke viser tegn på reaktion, vil du indikator skal putte i numsen. Disse bruges i kemi til at give et visuelt signal, når en opløsning når ækvivalenspunktet eller slutpunktet. Indikatorer bruges generelt til titreringer, der undersøger syre-base- og redoxreaktioner, men der er også flere andre indikatorer. Se en lærebog i kemi eller internettet for at finde en passende indikator for din reaktion. Hvis reaktionen resulterer i en ændring i pH eller potentiale, kan du sætte pH-læsere eller et potentiometer i kolben for at måle forløbet af den kemiske reaktion. For en mere nøjagtig titrering skal du overvåge pH-værdien eller potentialet som angivet ovenfor, og notere hvordan reaktionen forløber hver gang efter tilsætning af en lille mængde titrant. Tegn opløsningens surhedsgrad eller potentialet mod volumenet af den tilsatte titrant. Du vil se skarpe ændringer i kurvens hældning ved reaktionens ækvivalenspunkter. Optag den endelige lydstyrke i din burette. Ved at trække dette fra startvolumenet i buretten, kan du finde den nøjagtige mængde af titranten, du brugte. Antag for eksempel, at vi brugte 25 ml 0,5 M NaOH, når vi titrerede en opløsning af HCl i vand til ækvivalenspunktet. HCI-opløsningen havde et volumen på 60 ml til titreringen. Hvor mange mol HCl er der i vores opløsning? For at komme i gang, lad os se på den kemiske ligning for reaktionen mellem NaOH og HCl: NaOH + HCl > huh2O + NaCl I dette tilfælde reagerer 1 molekyle NaOH med 1 molekyle HCl for at producere vand og NaCl. Så fordi du tilføjede lige nok NaOH til at neutralisere al HCl, vil antallet af mol NaOH forbrugt i reaktionen være lig med antallet af mol HCl i kolben. Så lad os finde ud af, hvad mængden af NaOH er i mol. 25 ml NaOH = 0,025 L NaOH x (0,5 mol NaOH/1 L) = 0,0125 mol NaOH. Da vi ud fra reaktionsligningen har udledt, at de mol NaOH, der forbruges i reaktionen = mol HCl i opløsningen, ved vi nu, at der er 0,0125 mol HCl i opløsningen. For at finde molariteten af ovenstående eksempel divideres mol HCl med volumenet i kolben. 0,0125 mol HCI x (1/0,060 L) = 0,208 M HCI. For at konvertere molaritet til g/L, ppm eller procentdel af sammensætning, skal du konvertere mol af dit opløste stof til masse (ved hjælp af molmassen af dit opløste stof.) For ppm og procent af forbindelsen skal du også konvertere volumenet af din opløsning til masse (ved at bruge en omregningsfaktor som tæthed eller blot ved at veje den), og derefter gange resultatet med henholdsvis 10 eller 10. 

Titrere sølvnitratet fra en burette eller lille kanyle ind i akvarieprøven, indtil opløsningen bliver uklar. Med så lille en prøve er det vigtigt at Nemlig afgør, hvor meget sølvnitrat du har tilsat – undersøg hver dråbe omhyggeligt. 
Antag, at der er 3mL af 0,25 M AgNO3 var nødvendig, for at reaktionen kunne ophøre, og vandet formede ikke yderligere. 3 mL x 0,25 M = 0,003 L x (.25 mol AgNO3/1 L) = 0,000075 mol AgNO3. I dette tilfælde: 1 mol AgNO3 reagerer med 1 mol NaCl. Men hvis 1 mol titrant reagerer med 2 mol af vores opløste stof, så ville vi gange antallet af mol af vores titrant med 2 for at få mol af vores opløste stof. I modsætning hertil, hvis 2 mol af vores titrant reagerer med 1 mol af vores opløste stof, så dividerer vi antallet af mol af titranten med to. Disse regler svarer forholdsmæssigt til 3 mol titrant og 1 mol opløst stof, 4 mol titrant og 1 mol opløst stof osv. samt 1 mol titrant og 3 mol opløst stof, 1 mol titrant og 4 mol opløst stof osv. MM Na = 22.990. MM Cl = 35.453. 22.990 + 35.453 = 58,443 g/mol 0,000075 mol NaCl x 58,442 g/mol = 0,00438 mol NaCl. Vær opmærksom: Hvis der er mere end et af en slags molekyle i et atom, så skal du tilføje molmassen af det atom flere gange. For eksempel, hvis du tager den molære masse af AgNO3, Hvis du vil finde det, skal du tilføje massen eller oxygen tre gange, fordi der er tre oxygenatomer i molekylet. Saliniteten af havvand er omkring 35 g NaCl/L. Vores akvarium er ikke nær salt nok til havfisk.
Bestemmelse af koncentrationen af en opløsning
Indhold
I kemi eller kemi a opløsning en homogen blanding af to ting - en opløst stof og en opløsningsmiddel eller opløsningsmiddel hvori stoffet er opløst. Koncentration er et mål for mængden af opløst stof i et opløsningsmiddel. Der kan være mange grunde til at bestemme koncentrationen af en opløsning, men den involverede kemi er den samme, uanset om du tester klorniveauet i en swimmingpool eller udfører en livreddende analyse på en blodprøve. Denne vejledning vil lære dig nogle grundlæggende dele af løsningskemi og derefter lede dig gennem proceduren for en almindelig, praktisk anvendelse - akvarievedligeholdelse.
Trin
Del 1 af 3: Grundlæggende om koncentrationer
1. Notation af koncentrationer. En koncentration af et stof er mængden af det opløste stof divideret med mængden af opløsningsmiddel. Men fordi der er forskellige måder at udtrykke mængden af et givet stof på, er det også muligt at udtrykke en koncentration på forskellige måder. Her er de mest almindelige stavemåder:
- gram per liter (g/l.) Massen af et opløst stof i gram opløst i et givet volumen af en opløsning (hvilket ikke nødvendigvis er det samme som volumenet af opløsningsmidlet.) Anvendes normalt til opløsninger af faste stoffer i flydende opløsningsmidler.
- Molaritet (M.) Antallet af mol af et opløst stof divideret med opløsningens rumfang.
- Parts per million (ppm.) Forholdet mellem antallet af partikler (normalt i gram) af et opløst stof pr. en million dele af en opløsning ganget med 10. Anvendes normalt til meget fortyndet opløsning i vand (1 L vand = 1000 gram.)
- Procentdel af sammensat stof. Forholdet mellem partikler (igen i gram) af et opløst stof pr. 100 partikler af en opløsning, udtrykt i procent.
2. Ved, hvilke data du skal bruge for at finde en koncentration. Bortset fra molaritet (se nedenfor), kræver de almindelige stavemåder af en koncentration som angivet ovenfor, at du kender massen af det opløste stof og massen eller volumen af den resulterende opløsning. Mange kemiproblemer, der kræver at finde koncentrationen af en opløsning, giver dig ikke denne information. Hvis dette er tilfældet, bliver du nødt til at arbejde med det, du ved, for at få disse oplysninger.
3. Lær hvordan du beregner molaritet. Molaritet kræver, at du kender mol af dit opløste stof, men du kan nemt udlede dette, hvis du kender massen af det opløste stof og dets kemiske formel. Hvert kemisk grundstof har en kendt "Molar masse" (MM) – en specifik masse for et mol af dette grundstof. Disse molære masser kan findes i det periodiske system (normalt under det kemiske symbol og navnet på grundstoffet.) Tilføj blot molmasserne af komponenterne i det opløste stof for at beregne molmassen. Derefter ganges den kendte masse af det opløste stof med (1/MM af dit opløste stof) for at finde mængden af dit opløste stof i mol.
4. Øv standardøvelser i beregning af koncentrationer. Ovenstående viden er alt hvad du behøver for at beregne koncentrationerne i simple situationer. Hvis du kender massen eller volumen af opløsningen og mængden af tilsat opløst stof, eller kan udlede dette ud fra oplysningerne i øvelsen, bør du let kunne beregne koncentrationen af en opløsning. Lav øvelser for at forbedre dine færdigheder. Se eksempler på opgaver herunder:
Del 2 af 3: Titrering
1. Forstå, hvornår du skal anvende en titrering. Titrering er en teknik, der bruges af kemikere til at beregne mængden af opløst stof i en opløsning. For at udføre en titrering giver du en kemisk reaktion mellem det opløste stof og et andet reagens (normalt også opløst). Fordi du kender den nøjagtige mængde af dit andet reagens, og du kender den kemiske ligning for reaktionen mellem reagenset og det opløste stof, kan du beregne mængden af dit opløste stof ved at måle, hvor meget af reagenset du skal bruge til reaktionen med det opløste stof. komplet.
- Så titreringer kan være meget nyttige, når man beregner koncentrationen af en opløsning hvis du ikke ved, hvor meget opløst stof der i princippet blev tilsat.
- Hvis du ved, hvor meget af et opløst stof, der er til stede i opløsningen, er der ingen grund til at titrere - bare mål volumen af din opløsning og beregn koncentrationen, som beskrevet i del 1.
2. Indstil dit titreringsudstyr. For at udføre nøjagtige titreringer har du brug for rent, præcist og professionelt udstyr. Brug en Erlenmeyer-kolbe eller bæger under en kalibreret burette, fastgjort til en buretteholder. Burettens tuden skal passe ind i kolbens eller bægerets hals uden at røre ved væggene.
3. Fyld kolben og buretten. Mål nøjagtigt en lille mængde af den ukendte opløsning. Når stoffet er opløst, spredes det jævnt i opløsningsmidlet, så koncentrationen af denne lille prøve af opløsningen vil være den samme som den oprindelige opløsning. Fyld din burette med en opløsning af kendt koncentration, som vil reagere med din opløsning. Noter det nøjagtige volumen af opløsning i buretten – træk det endelige volumen fra for at finde den samlede opløsning, der blev brugt i reaktionen.
4. Start med titreringen. Tilsæt gradvist en opløsning fra buretten (de "titrant") i kolben. Brug en magnetomrører eller glasomrører til forsigtigt at blande opløsningen, mens reaktionen er i gang. Hvis din opløsning reagerer synligt, bør du se visse tegn på, at en reaktion er i gang - farveændring, bobler, rester mv. Hvis du bruger en indikator, kan du se en farveændring for hver dråbe, der ender i kolben gennem buretten.
5. Sænk din titrering. Når din kemiske reaktion nærmer sig slutpunktet, skal du sænke titreringen, indtil den skrider frem dråbe for dråbe. Hvis du bruger en indikator, kan du bemærke, at farveblinkene holder længere. Fortsæt nu med at titrere så langsomt som muligt, indtil du kan bestemme det nøjagtige fald, der får din reaktion til at nå slutpunktet. I tilfælde af en indikator leder man generelt efter den tidligst mulige vedvarende farveændring i reaktionen.
6. Beregn mængden af opløst stof i din opløsning. Brug den kemiske ligning for reaktionen mellem din titrant og opløsningen til at finde mol af opløst stof i din kolbe. Når du har fundet mol af opløst stof, kan du blot dividere med volumenet af opløsningen i kolben for at finde molariteten af opløsningen, eller omregne molerne til gram og dividere med opløsningens rumfang. koncentration i g/L. Dette kræver lidt grundlæggende viden om støkiometri.
7. Beregn koncentrationen af din opløsning. Nu hvor du kender mængden af opløst stof i din opløsning, er det nemt at finde koncentrationen i form af molaritet. Du skal blot dividere mol af opløst stof i din opløsning med volumenet af din opløsningsprøve (ikke mængden af den større mængde, du prøvede.) Resultatet er molariteten af din opløsning!
Del 3 af 3: Bestemmelse af saltholdighed i et akvarium

1. Tag en vandprøve fra dit akvarium. Optag lydstyrken nøjagtigt. Hvis det er muligt, mål volumen i SI-enheder såsom mL - disse er nemme at konvertere til L.
- I dette eksempel tester vi vandet i akvariet for saltholdighed, koncentrationen af salt (NaCl) i vandet. Antag, at vi tager en vandprøve til dette formål fra 3 ml fra akvariet og sæt derefter det endelige svar ind g/L.

2. Titrere vandprøven. Vælg en titrant, der frembringer en klart synlig reaktion i det opløste stof. I dette tilfælde bruger vi en opløsning på 0,25 M AgNO3 (sølvnitrat), en forbindelse, der producerer et uopløseligt klorsalt, når det reagerer med NaCl i følgende reaktion: AgNO3 + NaCl > NaNO3 + AgCl. Saltet (AgCl) vil være synligt som en uklar, hvid rest, der vil flyde og kan adskilles fra opløsningen.

3. Fortsæt indtil kommentaren stopper. Når sølvnitratet holder op med at uklare opløsningen, kan du registrere det tilføjede antal ml. Titrer AgNO3 meget langsom og observer løsningen nøje, især når slutpunktet nærmer sig.
4. Bestem antallet af mol af titranten. Dette trin er nemt - gange mængden af titrant, du tilføjede, med molariteten. Dette vil give dig antallet af anvendte mol titrant.
5. Bestem antallet af mol af dit opløste stof. Brug reaktionsligningen til omregning af antallet af mol AgNO3 til mol NaCl. Reaktionsligningen er: AgNO3 + NaCl > NaNO3 + AgCl. Fordi 1 mol AgNO3 reagerer med 1 mol NaCl, ved vi nu, at antallet af mol NaCl i vores opløsning = antallet af mol AgNO3 der er tilføjet: 0,000075 mol.
6. Konverter dit opløste antal mol til gram. For at gøre dette skal du beregne molmassen af det opløste stof og gange det med antallet af mol af dit opløste stof. For at finde molmassen af NaCl skal du bruge det periodiske system til at finde og lægge sammen atomvægtene af salt (Na) og klorid (Cl).
7. Beregn den endelige koncentration. Vi har massen af vores opløste stof i gram, og vi kender volumen af testopløsningen. Alt vi skal gøre nu er at dividere: 0,00438 g NaCl/0,003 L = 1,46 g NaCl/L
Tips
- Selvom det opløste stof og opløsningsmidlet kan eksistere i forskellige tilstande (fast, flydende eller gas), hvis de adskilles, vil den opløsning, der dannes, når stoffet opløses, være i samme tilstand som opløsningsmidlets tilstand.
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O
- Brug kun klar plast eller glas.
- Her er et eksempel på video:[1]
Advarsler
- Opbevar AgNO3-opløsningen i en lukket, mørk flaske. Den er følsom over for lys.
- Vær forsigtig, når du arbejder med stærke syrer eller baser. Sørg for, at der er nok frisk luft i rummet.
- Bær sikkerhedsbriller og handsker.
- Hvis du ønsker at få sølvet tilbage, skal du være opmærksom på følgende: Cu(s) + 2 AgNO3 (aq) → Cu(NO3)2 + 2 Ag (s) Husk at (s) betyder fast stof.
Artikler om emnet "Bestemmelse af koncentrationen af en opløsning"
Оцените, пожалуйста статью
Lignende
Populær