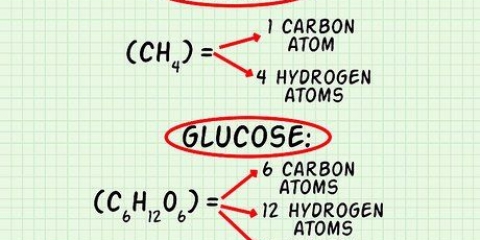
I dette eksempel indeholder et iltmolekyle ( ) to oxygenatomer.
) to oxygenatomer. Molmassen af et oxygenatom er omkring 16 g/mol. Om nødvendigt kan du beregne mere præcise værdier. 2 oxygenatomer x 16 g/mol pr. atom = 32 g/mol  .
. Det andet reagens, glucose ( ) har en molær masse på (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
) har en molær masse på (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol. Hvis du vil se dette trin mere detaljeret, så læs Beregning af molær masse. 
Antag for eksempel, at du starter med 40 gram ilt og 25 gram glukose. 40 g  / (32 g/mol) = 1,25 mol oxygen.
/ (32 g/mol) = 1,25 mol oxygen. 25 g  / (180 g/mol) = ca. 0,139 mol glucose.
/ (180 g/mol) = ca. 0,139 mol glucose. 
I det følgende eksempel starter du med 1,25 mol ilt og 0,139 mol glukose. Så forholdet mellem oxygen- og glucosemolekyler er 1,25/0,139 = 9,0. Dette forhold betyder, at du har ni gange så mange iltmolekyler som glukose. 
Til denne reaktion er reaktanterne angivet som  . Koefficienterne indikerer, at du har brug for seks iltmolekyler for hvert glukosemolekyle. Det ideelle forhold for denne reaktion er 6 oxygen / 1 glucose = 6,0.
. Koefficienterne indikerer, at du har brug for seks iltmolekyler for hvert glukosemolekyle. Det ideelle forhold for denne reaktion er 6 oxygen / 1 glucose = 6,0. 
I det følgende eksempel starter du med ni gange så meget ilt som glukose, målt på antallet af mol. Formlen fortæller dig, at dit ideelle forhold er seks gange så meget ilt til glukose. Så du har brug for mere ilt end glukose. Så det andet reagens, glucose i dette tilfælde, er det begrænsende reagens. 

I eksemplet ovenfor er glucose det begrænsende reagens. Ifølge molmasseberegningerne er de første 25 g glucose lig med 0,139 mol glucose. 
Ligevægtsreaktionen for dette eksempel er  →
→  . Denne ligning fortæller dig, at du kan forvente seks molekyler af det ønskede produkt, kuldioxid (
. Denne ligning fortæller dig, at du kan forvente seks molekyler af det ønskede produkt, kuldioxid ( ), og et molekyle glucose (
), og et molekyle glucose ( ).
). Forholdet mellem kuldioxid og glucose er 6/1 = 6. Med andre ord kan denne reaktion producere seks molekyler kuldioxid fra et molekyle glucose. 
I dette eksempel er de 25 g glucose lig med 0,139 mol glucose. Forholdet mellem kuldioxid og glucose er 6:1. Du forventer at kunne producere seks gange så mange mol kuldioxid som de mol glukose du startede med. Det teoretiske udbytte af kuldioxid er (0,139 mol glucose) x (6 mol kuldioxid/mol glucose) = 0,834 mol kuldioxid. 
I det følgende eksempel er den molære masse af CO2 ca. 44 g/mol. (Molmassen af kulstof er ~12 g/mol og ilt ~16 g/mol, så totalen er 12 + 16 + 16 = 44). Multiplicer 0,834 mol CO2 x 44 g/mol CO2 = ~36,7 gram. Det teoretiske udbytte af eksperimentet er 36,7 gram CO2. 
I dette eksempel er vand det andet produkt  . Ifølge ligevægtsreaktionen kan du forvente seks vandmolekyler fra et glukosemolekyle. Dette er et forhold på 6:1. Så 0,139 mol glukose skulle resultere i 0,834 mol vand.
. Ifølge ligevægtsreaktionen kan du forvente seks vandmolekyler fra et glukosemolekyle. Dette er et forhold på 6:1. Så 0,139 mol glukose skulle resultere i 0,834 mol vand. Gang molerne vand med vandets molære masse. Den molære masse er 2 + 16 = 18 g/mol. Multipliceret med produktet resulterer dette i 0,139 mol H2O x 18 g/mol H2O = ~2,50 gram. Det teoretiske udbytte af vand i dette forsøg er 2,50 gram.
Beregning af teoretisk udbytte
Indhold
Teoretisk udbytte er et udtryk, der bruges i kemi for den maksimale mængde af et stof opnået, som du forventer ved en kemisk reaktion. Du starter med at afbalancere en reaktionsligning og definere det begrænsende reagens. Når du måler mængden af reagens, du vil bruge, kan du beregne mængden af et stof, der opnås. Dette er det teoretiske udbytte af ligningen. I et egentligt eksperiment vil du sandsynligvis miste noget af det, fordi det ikke er et ideelt eksperiment.
Trin
Del 1 af 2: Bestemmelse af det begrænsende reagens

1. Start med en ligevægtsreaktion. En reaktionsligning ligner en opskrift. Den viser hvilke reagenser (til venstre) der reagerer med hinanden for at producere produkter (til højre). En ligevægtsreaktion vil have det samme antal atomer på venstre side af ligningen (som reaktanter) som på højre side (i form af produkter).
- Antag for eksempel, at vi har den simple ligning
→
. Der er to brintatomer til venstre og højre. Men der er to iltatomer som reaktant til venstre og kun et atom som produkt til højre.
- For at balancere ligningen fordobler vi produktet, og vi får
→
.
- Tjek balancen. Denne ændring har fået ilten til at slå, fordi den nu har to atomer på begge sider. Men du har nu to brintatomer til venstre med fire brintatomer til højre.
- Dobbelt brint i reagenset. Dette gør ligningen
→
. Denne ændring har nu resulteret i fire brintatomer og to oxygenatomer på hver side. Ligningen er i ligevægt.
- Et mere kompliceret eksempel: oxygen og glucose kan reagere og danne kuldioxid og vand:
→
I denne ligning har hver side nøjagtigt 6 carbonatomer (C), 12 hydrogenatomer (H) og 18 oxygenatomer (O). Ligningen er i ligevægt. - Læs denne artikel hvis du vil tjekke reaktionsligningerne mere grundigt.

2. Beregn molmassen af hver reaktion. Brug det periodiske system eller en anden opslagsbog til at finde den molære masse af hvert atom i hver forbindelse. Tilføj dem sammen for at finde den molære masse af hver forbindelse af reaktanter. Gør dette for et enkelt molekyle af sammensætningen. Se igen på ligningen for omdannelsen af oxygen og glukose til kuldioxid og vand:  →
→ 
 →
→ 
 ) to oxygenatomer.
) to oxygenatomer. .
. ) har en molær masse på (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
) har en molær masse på (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
3. Konverter mængden af hvert reagens fra gram til mol. For et egentligt eksperiment vil massen i gram af hvert reagens, du bruger, være kendt. Divider denne værdi med den molære masse af det pågældende stof som konvertering til antallet af mol.
 / (32 g/mol) = 1,25 mol oxygen.
/ (32 g/mol) = 1,25 mol oxygen. / (180 g/mol) = ca. 0,139 mol glucose.
/ (180 g/mol) = ca. 0,139 mol glucose.
4. Bestem molforholdet mellem reaktanterne. En muldvarp er et beregningsværktøj, der bruges i kemi til at tælle molekyler baseret på deres masse. Ved at bestemme mol af både ilt og glukose ved du, hvor mange molekyler af hver du starter med. For at finde forholdet mellem de to skal du dividere mol af den ene reaktant med den andens.

5. Bestem det ideelle forhold for reaktionen. Se ligevægtsreaktionen. Koefficienterne for hvert molekyle fortæller dig forholdet mellem de molekyler, du skal bruge for at reaktionen kan finde sted. Hvis du bruger nøjagtigt forholdet givet af formlen, så skal begge reaktanter bruges ligeligt.
 . Koefficienterne indikerer, at du har brug for seks iltmolekyler for hvert glukosemolekyle. Det ideelle forhold for denne reaktion er 6 oxygen / 1 glucose = 6,0.
. Koefficienterne indikerer, at du har brug for seks iltmolekyler for hvert glukosemolekyle. Det ideelle forhold for denne reaktion er 6 oxygen / 1 glucose = 6,0.
6. Sammenlign forholdene for at finde det begrænsende reagens. I de fleste kemiske reaktioner vil en af reaktanterne blive brugt hurtigere end den anden. Det reagens, der bruges først, kaldes det begrænsende reagens. Dette begrænsende reagens bestemmer, hvor længe den kemiske reaktion kan fortsætte, og det teoretiske udbytte, du kan forvente. Sammenlign de to forhold, du har beregnet for at bestemme det begrænsende reagens:
Del 2 af 2: Bestemmelse af det teoretiske udbytte

1. Se kommentaren for at finde det ønskede produkt. Den højre side af en kemisk ligning viser de produkter, reaktionen producerer. Hvis reaktionen er afbalanceret, angiver koefficienterne for hvert produkt, hvor mange af hvert molekylært forhold man kan forvente. Hvert produkt har et teoretisk afkast, eller den mængde produkt, du ville forvente, når reaktionen er fuldstændig komplet.
- Hvis du fortsætter med ovenstående eksempel, analyserer du reaktionen
→
. De to produkter til højre er kuldioxid og vand.
- Du kan starte med begge produkter, hvis du vil beregne det teoretiske udbytte. I nogle tilfælde er det muligt, at du kun er interesseret i et af de to produkter. Hvis ja, er det den, du skal starte med.

2. Skriv ned molene af dit begrænsende reagens. Du bør altid sammenligne antallet af mol af begrænsende reagens med antallet af mol af et produkt. Hvis du forsøger at sammenligne massen af hver, får du ikke det korrekte resultat.

3. Sammenlign forholdet mellem molekylerne i produktet og reagenset. Vend tilbage til ligevægtsreaktionen. Divider antallet af molekyler af dit ønskede produkt med antallet af molekyler af dit begrænsende reagens.
 →
→  . Denne ligning fortæller dig, at du kan forvente seks molekyler af det ønskede produkt, kuldioxid (
. Denne ligning fortæller dig, at du kan forvente seks molekyler af det ønskede produkt, kuldioxid ( ), og et molekyle glucose (
), og et molekyle glucose ( ).
).
4. Multiplicer dette forhold med antallet af mol af det begrænsende reagens. Svaret er det teoretiske udbytte, i mol, af det ønskede produkt.

5. Konverter resultatet til gram. Dette er det omvendte af dit forrige trin til at beregne antallet af mol eller mængden af reagens. Hvis du kender antallet af mol, du kan forvente, skal du gange det med produktets molære masse for at bestemme det teoretiske udbytte i gram.

6. Gentag beregningen for det andet produkt, hvis det ønskes. I mange eksperimenter er du måske kun interesseret i effektiviteten af et bestemt produkt. Hvis du vil vide det teoretiske udbytte af begge produkter, skal du blot gentage processen.
 . Ifølge ligevægtsreaktionen kan du forvente seks vandmolekyler fra et glukosemolekyle. Dette er et forhold på 6:1. Så 0,139 mol glukose skulle resultere i 0,834 mol vand.
. Ifølge ligevægtsreaktionen kan du forvente seks vandmolekyler fra et glukosemolekyle. Dette er et forhold på 6:1. Så 0,139 mol glukose skulle resultere i 0,834 mol vand.Artikler om emnet "Beregning af teoretisk udbytte"
Оцените, пожалуйста статью
Populær