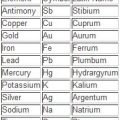
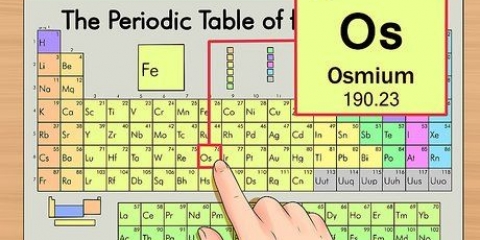
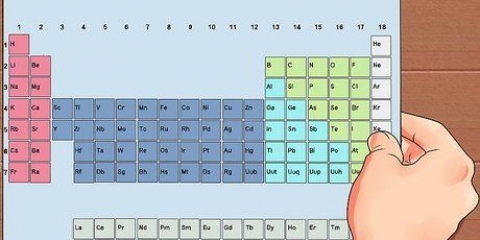
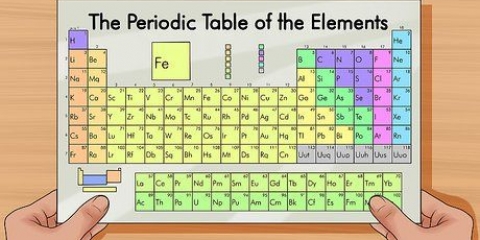
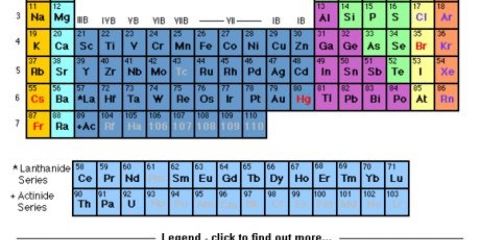
Brug udtrykket `at læse en gruppe ned` til at læse fra top til bund. Nummereringen er normalt angivet over kolonnerne; det kan dog også falde ind under andre grupper, såsom metallerne. Nummereringen, der bruges i det periodiske system, er meget forskellig. De kan være romerske (IA), arabiske (1A) eller tallene 1 til 18. Brint kan være i halogenfamilien og alkalimetallerne eller begge dele. 
Perioder er normalt nummereret fra 1 til 7 i venstre side af tabellen. Hver periode er større end den foregående. Dette er relateret til at øge energiniveauerne for atomerne i det periodiske system. 
Gruppen Metaller har én farve. Imidlertid har brint ofte samme farve og gruppe som ikke-metallerne. Metaller har glans, er normalt faste ved stuetemperatur, leder varme og elektricitet og er formbare og formbare. Ikke-metaller har samme farve. Disse er grundstofferne C-6 til og med Rn-86, inklusive H-1 (brint). De har ingen glans, leder varme og elektricitet og er ikke formbare. De danner normalt en gas ved stuetemperatur og kan være fast, gas eller væske. Halvmetaller/metalloider har normalt en lilla eller grøn farve, som en kombination af de to andre farver. Linjen er diagonal og strækker sig fra elementerne B-5 til At-85. De har nogle egenskaber af metaller og nogle af ikke-metaller. 
Nummereringen kan være romerske, arabiske eller standardtal. 





Bemærk venligst, at der er en undtagelse fra denne regel. Hvis atomet mister eller får elektroner, bliver det en elektrisk ladet ion. Hvis der er et plustegn ved siden af elementets symbol, indikerer det, at det er positivt ladet. Med et minussymbol er den negativt ladet. Hvis det ikke har et plus- eller minussymbol, og dit kemiproblem ikke handler om ioner, så er antallet af protoner og elektroner sandsynligvis det samme. 


For eksempel: Atommassen af jern er 55,847, så massetallet er 56. Grundstoffet har 26 protoner. 56 (massetal) minus 26 (protoner) er 30. Der er normalt 30 neutroner i et enkelt jernatom. Ændring af antallet af neutroner i et atom danner isotoper, som er tungere eller lettere versioner af atomet.
Forstå grundstoffernes periodiske system
Indhold
Det periodiske system af grundstoffer er en liste over de 118 grundstoffer, der er opdaget indtil videre. Der er flere symboler og tal, der angiver forskellene i elementerne, mens tabellens struktur organiserer elementerne efter ligheder. Du kan læse det periodiske system ved hjælp af retningslinjerne nedenfor.
Trin
Del 1 af 4: Forståelse af strukturen

1. Tænk på det periodiske system som starter øverst til venstre og slutter i slutningen af den sidste række, nederst og til højre. Tabellen er struktureret fra venstre mod højre i rækkefølge efter stigende atomnummer. Atomnummeret er antallet af protoner i et enkelt atom.
- Ikke hver række eller kolonne er komplet. Selvom der kan være huller i midten, skal du fortsætte med at læse tabellen fra venstre mod højre. For eksempel har brint atomnummer 1 og er i øverste venstre hjørne. Helium har atomnummer 2 og er placeret i øverste højre hjørne.
- Elementer 57 til 71 er normalt afbildet som en delmængde i nederste højre hjørne af tabellen. Disse er de `sjældne jordelementer`.

2. I hver kolonne i tabellen finder du en `gruppe` af elementer. Der er 18 kolonner.

3. I hver række i tabellen finder du elementernes `perioder`. Der er 7 perioder. Brug udtrykket `læse langs en periode` til at læse fra venstre mod højre.

4. Forstå de yderligere grupper til metal, semi-metal og ikke-metal. Farverne varierer meget.

5. Vid, at elementerne nogle gange også er angivet i familier. Disse er alkalimetallerne (1A), jordalkalimetallerne (2A), halogener (7A), ædelgasser (8A) og carbonatomer (4A).
Del 2 af 4: Forståelse af symbolet og navngivning

1. Læs symbolet først. Den består af et eller to bogstaver og er standard på flere sprog.
- Symbolet kan være afledt af elementets latinske navn eller det almindelige almindelige navn.
- I mange tilfælde følger symbolet den engelske navnekonvention, såsom Helium, aka `He`. Det er dog ikke en regel, man kan gå ud fra. For eksempel er jern `Fe`. Af denne grund huskes symbol/navn-kombinationen normalt for hurtig reference.

2. Se på det almindelige navn. Dette er direkte under symbolet. Det er forskelligt afhængigt af det sprog, som det periodiske system er skrevet på.
Del 3 af 4: Aflæsning af atomnummer

1. Læs det periodiske system i henhold til atomnummeret øverst i midten af boksen med hvert grundstof. Som før nævnt er systemet ordnet fra øverst til venstre til nederst til højre. At kende atomnummeret er den hurtigste måde at finde flere oplysninger om grundstoffet på.

2. Atomnummeret er antallet af protoner i kernen af et enkelt atom i grundstoffet.

3. Tilføjelse eller fjernelse af protoner skaber et andet element.

4. At finde ud af antallet af protoner i et atom er også bestemmende for antallet af elektroner. Atomer har det samme antal elektroner som protoner.
Del 4 af 4: Aflæsning af atommassen

1. Bestem atommassen. Dette er nummeret under elementets almindelige navn.
- Selvom det kan se ud til, at atommassen stiger fra øverst til venstre i systemet til nederst til højre, er dette ikke sandt i alle tilfælde.

2. Forstå, at de fleste elementer vises med decimaler. Atommassen er summen af partiklerne i kernen; det er dog et vægtet gennemsnit af de forskellige isotoper.

3. Brug atommassen til at finde antallet af neutroner i et enkelt atom. Afrund atommassen til nærmeste hele tal, massetallet. Derefter trækker du antallet af protoner fra massetallet for at finde antallet af neutroner.
Artikler om emnet "Forstå grundstoffernes periodiske system"
Оцените, пожалуйста статью
Populær