Hvis det er en decimal, ser du sandsynligvis på atommassen. 
Der kan være et tomt rum efter grundstofferne 56 (barium) og 88 (radium). Der er faktisk ikke et mellemrum; grundstofferne med de atomnumre, der hører hjemme, er i to rækker under resten af systemet. Den eneste grund til, at de er adskilt sådan, er at gøre det periodiske system mindre bredt. 
For at sige det på en anden måde er ethvert atom med otte protoner et oxygenatom. To oxygenatomer kan have et forskelligt antal neutroner eller (hvis den ene er en ion) et forskelligt antal elektroner, men de vil begge altid have otte protoner. 

I praksis er atommassen normalt allerede givet for kemiproblemer, der kun omhandler ét atom. Forstå dette koncept for ikke at blive overrasket, hvis det adskiller sig fra atomvægten. 
Dette virker, fordi neutroner og protoner begge er tæt på 1 AMU og elektroner er tæt på 0 AMU. For atomvægten bruges præcise mål for at få decimaltallet, men vi er kun interesserede i de heltal, der fortæller os antallet af protoner og neutroner. Husk, at hvis du bruger atomvægten, får du et gennemsnit for en typisk prøve. En bromprøve har et massetal på omkring 80, men som det viser sig, har et enkelt bromatom næsten altid et massetal på 79 eller 81. 
Et enkelt heliumatom (He) har et massetal på 4 og et atomnummer på 2. Derfor skal det være 4 - 2 = 2 neutroner at have. En prøve af sølv (Ag) har et massetal på omkring 108 (ifølge det periodiske system) og et atomnummer på 47. I gennemsnit har hvert sølvatom i prøven 108 - 47 = 61 neutroner. 
Isotoper har ikke et andet atomnummer. Hver isotop af et grundstof har det samme antal protoner.
Bestem et grundstofs atomnummer
Et grundstofs atomnummer er antallet af protoner i kernen af et enkelt atom af det pågældende grundstof. Atomnummeret for et grundstof eller en isotop ændres ikke, så du kan bruge atomnummeret til at beregne andre karakteristika for et grundstof eller en isotop, såsom antallet af neutroner.
Trin
Del 1 af 2: At finde atomnummeret

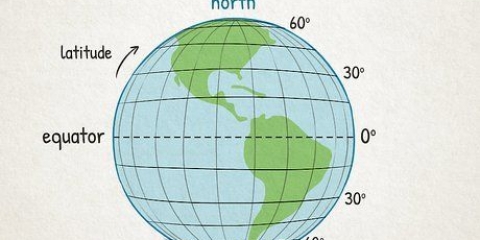
1. Find en kopi af det periodiske system. Du kan finde en her, hvis du ikke har en ved hånden. Hvert grundstof har et forskelligt atomnummer, så der er ingen hurtige og nemme metoder at anvende. Du skal enten finde en kopi af det periodiske system eller en skal lære udenad.
- De fleste kemibøger har et periodisk system trykt på indersiden.

2. Find det element, du studerer. De fleste periodiske system indeholder de fulde navne på de forskellige grundstoffer, såvel som deres kemiske symboler (såsom Hg for kviksølv). Hvis du har problemer med at finde grundstoffet, skal du søge online efter `kemisk symbol` efterfulgt af navnet på grundstoffet.

3. Find atomnummeret. Atomnummeret er normalt i øverste venstre eller højre hjørne af den boks, grundstoffet er i, men det kan også være et andet sted i boksen. Atomnummeret er altid et helt tal.

4. Verificer mod tilstødende elementer. Det periodiske system er arrangeret efter atomnummer. Hvis dit grundstofs atomnummer er `33`, så skal grundstoffet til venstre være `32` og grundstoffet til højre skal være `34`. Hvis denne rækkefølge er korrekt, har du helt sikkert fundet atomnummeret.

5. Forstå hvad atomnummeret er. Der er en simpel definition for et grundstofs atomnummer: antallet af protoner i et atom af det grundstof. Dette er den grundlæggende definition af et element. Antallet af protoner bestemmer kernens samlede elektriske ladning, som bestemmer hvor mange elektroner et atom kan have. Da elektroner er ansvarlige for næsten alle kemiske reaktioner, bestemmer atomnummeret indirekte næsten alle fysiske og kemiske egenskaber af et grundstof.
Del 2 af 2: Find relaterede oplysninger

1. At finde atomvægten. Atomvægten er normalt trykt under navnet på det pågældende grundstof i det periodiske system og beregnes normalt med to eller tre decimaler. Dette er den gennemsnitlige masse af et atom af grundstoffet, justeret til at matche det, du sandsynligvis støder på i naturen. Dette tal er i "atomic masse units" (AMU (fra engelsk "atomic mass unit")).
- Nogle videnskabsmænd bruger udtrykket "relativ atommasse" i stedet for "atomvægt".

2. Forstå hvad atommassen er. Atommasse er et begreb, der ligner meget atomvægt. Den eneste forskel er, at du taler om et specifikt atom i stedet for gennemsnittet af en prøve. Et gram jern indeholder en masse atomer med masser, der adskiller sig lidt fra hinanden, så du leder efter den `relative vægt` for at finde gennemsnittet. Hvis du kun er interesseret i ét specifikt jernatom, betyder gennemsnittet ikke noget for dig - du er kun interesseret i den nøjagtige masse af det pågældende atom.

3. Afrund til massetal. Massetallet er det samlede antal protoner plus neutroner i et atom af et grundstof. Du kan nemt finde dette tal: tag blot atomvægten angivet i det periodiske system og afrund til nærmeste hele tal.

4. Beregn antallet af neutroner. Du ved nu, at atomnummeret = antallet af protoner, og at massetallet = antallet af protoner + antallet af neutroner. For at finde ud af, hvor mange neutroner der er i et grundstof, skal du trække atomnummeret fra massetallet. Her er et par eksempler:

5. Forstå hvad isotoper er. En isotop er en bestemt form for et grundstof med et vist antal neutroner. Når et kemispørgsmål taler om "bor-10" eller "B", taler de om grundstoffet bor med et massetal på 10. Brug dette massetal i stedet for værdien for `typisk` bor.
Tips
- Nogle tungere grundstoffer har atomvægte indesluttet i parentes eller parentes. Dette betyder, at atomvægten er den nøjagtige masse af den mest stabile isotop, snarere end gennemsnittet af flere isotoper. (Dette har ingen indflydelse på grundstoffets atomnummer.)
Artikler om emnet "Bestem et grundstofs atomnummer"
Оцените, пожалуйста статью
Populær