For eksempel: Et natriumatom med en ladning på -1 har så en ekstra elektron tilføjet til atomnummeret 11. Så dette natriumatom har 12 elektroner i alt. s orbital (ethvert tal i elektronkonfigurationen efterfulgt af a "s") indeholder en enkelt orbital, og på grund af Pauli .s udelukkelsesprincip vi ved, at en enkelt orbital maksimalt kan indeholde 2 elektroner, så enhver orbitalform kan indeholde 2 elektroner. p-orbitalen indeholder 3 orbitaler, så kan rumme i alt 6 elektroner. D-orbitalen indeholder 5 orbitaler, så den kan rumme 10 elektroner. F-orbitalen indeholder 7 orbitaler, så den kan rumme 14 elektroner. For eksempel en simpel elektronkonfiguration: 1s 2s 2p. Denne konfiguration indikerer, at der er to elektroner i 1s orbital form, to elektroner i 2s orbital form og seks elektroner i 2p orbital form. 2 + 2 + 6 = 10 elektroner i alt. Dette er elektronkonfigurationen af et uladet neonatom (Ne; atomnummer 10.) En elektronkonfiguration af et atom, hvor hver orbital er fuldstændig fyldt, skrives som følger: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p Bemærk, at i ovenstående liste, hvis alle skaller er fyldt, er dette elektronkonfigurationen af ununoctium (Uuo; atomnummer 118), det højeste tal i det periodiske system - så denne elektronkonfiguration indeholder alle nu kendte elektronskaller i et uladet atom. Fyld orbitalerne med elektroner i rækkefølgen ovenfor, indtil du når tyve. 1`erens orbital får to elektroner, 2`eren får to, 2p`eren får seks, 3`eren får to, 3p`eren får 6, og 4`eren får 2 (2 + 2 + 6 +2 +6 + 2 = 20.) Så elektronkonfigurationen for calcium er: 1s 2s 2p 3s 3p 4s. Bemærk: Energiniveauerne ændres, efterhånden som du stiger. For eksempel, hvis du er ved at gå videre til det 4. energiniveau, vil det være 4 s. først, bagefter 3d. Efter det fjerde niveau fortsætter du med det femte niveau, hvor den normale rækkefølge genoptages. Dette sker først efter det 3. energiniveau. De to kolonner yderst til venstre er en repræsentation af atomer, hvis elektronkonfigurationer ender i s-orbitaler, den højre blok i denne tabel er en repræsentation af atomer, hvis konfigurationer ender i p-orbitaler, den centrale del, atomerne, der ender i en d-orbitaler, og den nedre region, atomer, der ender i f orbitaler. Når du for eksempel skriver en elektronkonfiguration for klor (Cl), skal du overveje: "Dette atom er i tredje række (eller "tidsrum") i det periodiske system. Det er også i den femte kolonne i gruppen af p-orbitaler. Så denne elektronkonfiguration ender i ...3 s Bemærk - grupperne af d- og f-orbitaler i tabellen svarer til energiniveauer, der er forskellige fra den periode, hvor de er placeret. For eksempel svarer den første række af gruppe d-orbitaler til 3d-orbitalen, selvom den er i periode 4, mens den første række af f-orbitaler svarer til 4f-orbitaler, selvom den er i sjette periode. For at forstå dette koncept godt, er det nyttigt at nedskrive et eksempel på en konfiguration. Lad os skrive konfigurationen af zink (atomnummer 30) ved hjælp af den forkortede notation for en ædelgas. Den komplette elektronkonfiguration af zink er: 1s 2s 2p 3s 3p 4s 3d. Men bemærk, at 1s 2s 2p 3s 3p er konfigurationen af ædelgassen argon. Bare udskift denne del af zinknotationen med det kemiske symbol for argon i firkantede parenteser ([Ar].) Så den forkortede notation af elektronkonfigurationen af zink kan skrives som [Ar]4s 3d. 
Gå til tallene 1 til 8 i bunden (bunden) af bordet. Dette er numrene på elektronskallene eller søjlerne. Ignorer de overstregede kolonner. Søjlerne tilbage for erbium er 1,2,3,4,5 og 6. Bemærk: Ovenstående elektronkonfiguration af Er (erbium) er angivet i rækkefølgen af stigende skalnumre. Det kan også skrives i rækkefølgen af orbitaler. Bare følg kaskaderne fra top til bund, i stedet for kolonnerne, hvis du skriver kolonnegrupperne ned: 1s 2s 2p 3s 3p 4s 3d 4p 5s4d 5p 6s 4f. cr(..., 3d5, 4s1); Cu(..., 3d10, 4s1); NB(..., 4d4, 5s1); mo(..., 4d5, 5s1); ru(..., 4d7, 5s1); Rh(..., 4d8, 5s1); pd(..., 4d10, 5s0); Ag(..., 4d10, 5s1); La(..., 5d1, 6s2); Ce(..., 4f1, 5d1, 6s2); Gd(..., 4f7, 5d1, 6s2); au(..., 5d10, 6s1); ac(..., 6d1, 7s2); tho(..., 6d2, 7s2); pa(..., 5f2, 6d1, 7s2); DU(..., 5f3, 6d1, 7s2); np(..., 5f4, 6d1, 7s2) og cm(..., 5f7, 6d1, 7s2).
Skrivning af elektronkonfigurationer for elementer
Indhold
Det elektron konfiguration af et atom er en numerisk repræsentation af elektronorbitaler. Elektron orbitaler er forskelligt formede områder omkring kernen af et atom, hvor det kan påvises matematisk, at der er en chance for, at elektroner er til stede der. Det er nemt og hurtigt at aflæse fra en elektronkonfiguration, hvor mange elektronorbitaler et atom har, og hvor mange elektroner der er til stede i hver orbital. Her lærer du, hvordan du begynder at skabe din egen elektronkonfiguration.
Trin
Metode 1 af 2: Metode 1: Tildel elektroner ved hjælp af det periodiske system

1. Find atomnummeret. Hvert atom har et tilknyttet specifikt antal elektroner. Find det kemiske symbol på dit atom i det periodiske system. Atomnummeret er et positivt heltal, der starter ved 1 (for brint) og stiger med 1 for hvert efterfølgende atom. Atomnummeret er antallet af protoner i det atom - så det er også antallet af elektroner i det atom, hvis det er uladet.
2. Bestem ladningen af atomet. Uladede atomer har nøjagtig det samme antal protoner som elektroner, som angivet i det periodiske system. Men det er ikke tilfældet med ladede atomer. Hvis du har at gøre med et ladet atom, skal du tilføje eller subtrahere elektronerne som følger: tilføj en elektron for hver negativ ladning og træk en fra for hver positiv ladning.
3. Husk den grundlæggende liste over orbitaler. Når et atom får elektroner, fylder de forskellige sæt orbitaler i en fast rækkefølge. Hver orbital, når den er fuld, indeholder et fast antal elektroner. Orbitalformerne er:
4. Forstå notationen af en elektronkonfiguration. Elektronkonfigurationer noteres på en sådan måde, at det er tydeligt, hvor mange elektroner der er til stede i atomet, og hvor mange elektroner der er i hver orbital. En orbital har en fast notation med antallet af elektroner i hævet efter navnet på orbitalen. Den endelige elektronkonfiguration er en række orbitale former og overskrifter.
5. Lær rækkefølgen af orbitalerne.Bemærk, at orbitalformerne er nummereret af elektronskallen, men ordnet efter energiniveau. For eksempel har en fuldt udfyldt 4`er mindre energi (eller mindre potentiale) end en delvist fyldt eller fyldt 3d, så 4`er-skallen er foran. Hvis du kender rækkefølgen af orbitaler, er det ikke svært at fylde dem efter antallet af elektroner i atomet. Rækkefølgen, hvori orbitalerne er udfyldt, er som følger: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
6. Fyld orbitalerne efter antallet af elektroner i dit atom. Hvis vi for eksempel ville skrive elektronkonfigurationen af et uladet calciumatom, ville vi starte med at slå atomnummeret op i det periodiske system. Atomnummeret for calcium er 20, så vi skriver en konfiguration for dette atom med 20 elektroner i rækkefølgen vist ovenfor.
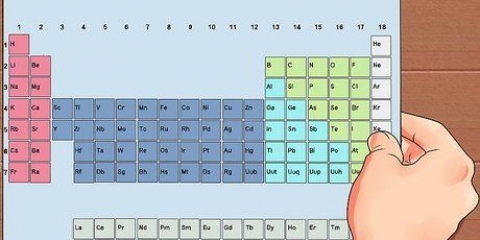
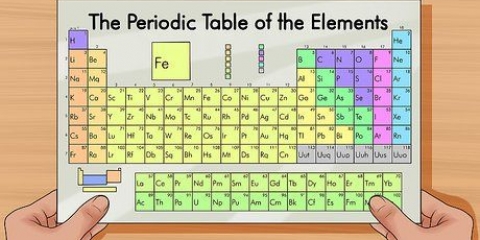
7. Brug det periodiske system som en visuel hjælp. Du har måske bemærket, at rækkefølgen af det periodiske system svarer til rækkefølgen af orbitalformerne i elektronkonfigurationer. For eksempel slutter atomer i anden kolonne til venstre altid med "s", atomer yderst til højre i det smalle midtersektion ender altid på "d," etc. Brug det periodiske system som en visuel guide til at notere konfigurationer - rækkefølgen, hvori du tilføjer elektroner til orbitalerne, svarer til positionen i tabellen i det periodiske system. Tag et godt kig på følgende:
8. Lær stenografi til at skrive lange elektronkonfigurationer. Atomerne langs højre side af det periodiske system kaldes ædelgasser. Disse elementer er meget stabile. For at forkorte processen med at notere en lang elektronkonfiguration, skriv det kemiske symbol for den nærmeste gas, med færre elektroner end dit atom, i firkantede parenteser, og fortsæt derefter med elektronkonfigurationen for følgende orbitalformer. Se nedenunder:
Metode 2 af 2: Metode 2: Gør brug af et ADOMAH periodisk system

1. Forståelse af ADOMAH periodiske system. Med denne metode til at notere elektronkonfigurationer er det ikke nødvendigt at huske meget. Men det kræver et anderledes opstillet periodisk system, for inden for det traditionelle periodiske system svarer elektronskallerne, startende fra fjerde række, ikke til de periodiske tal. Prøv at finde et eksempel på dette system designet af Valery Tsimmerman online. Dette er bestemt ikke et problem.
- Inden for det periodiske system ADOMAH repræsenterer rækkerne grupper af grundstoffer, såsom halogener, inerte gasser, alkalimetaller osv.Søjlerne svarer til elektronskallerne og "kaskaderne" (diagonale linjer, der forbinder s,p,d og f grupper) svarer til perioderne.
- Helium er nu ved siden af brint, fordi begge er karakteriseret ved 1s orbitalen. Punkterne (s,p,d og f) er til højre og skaltallene nederst i tabellen. Elementer er angivet i felter nummereret 1 til 120. Disse tal står for de almindelige atomnumre og angiver antallet af elektroner i et neutralt atom.
2. Søg efter dit atom i ADOMAH-tabellen. For at kunne nedskrive elektronkonfigurationen af et grundstof, søg efter dets symbol i det periodiske system ADOMAH og kryds alle grundstoffer med højere atomnumre ud. For eksempel, hvis du ønsker at kende elektronkonfigurationen af erbium (68), krydselementer 69 til 120.
3. Tæl orbitalerne op til dit atom. Ved at se på gruppen af symboler på højre side af tabellen (s, p, d og f) og kolonnenumrene nederst i tabellen og ignorere de diagonale linjer mellem dem, kan du opdele kolonnerne i grupper og liste fra bund til top. Igen, ignorer de blokke med alle elementer overstreget. Skriv kolonnegrupperne ned, startende med kolonnenummeret efterfulgt af gruppesymbolet, sådan her: 1s2s2p3s3p3d4s4p4d4f5s5p6s (i tilfælde af erbium).
4. Tæl elektronerne i hver orbitalform. Tæl de elementer, der ikke er overstreget i hver søjlegruppe, vælg én elektron pr. grundstof, og skriv tallet ud for gruppesymbolerne for hver søjlegruppe, således: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. Dette er elektronkonfigurationen af Er (erbium) fra vores eksempel.
5. Kend de uregelmæssige elektronkonfigurationer. Der er atten undtagelser fra elektronkonfigurationerne i atomer med det laveste energiniveau, også kendt som grundtilstanden. Disse afviger fra den generelle regel for de sidste to eller tre elektronpositioner. I disse tilfælde holder de faktiske elektronkonfigurationer elektronerne på et lavere energiniveau end i en standardkonfiguration af det atom. De uregelmæssige atomer er:
Tips
- For at finde et atoms atomnummer, når det er skrevet i form af en elektronkonfiguration, skal du tilføje alle de tal, der kommer efter bogstaverne (s, p, d og f). Dette virker kun på et neutralt atom, ikke en ion, og du skal trække eller tilføje alle de elektroner, der går tabt eller tilføjet.
- Tallet efter bogstavet står faktisk i hævet, så tag ikke fejl af dette med en test.
- Der er ikke sådan noget som "stabilitet af en halvfyldt" underniveau. Dette er for simpelt. Stabiliteten skyldes, at hver orbital kun er optaget af én elektron, så elektron-elektron frastødning er minimal.
- Hvert atom ønsker at vende tilbage til en stabil tilstand, og de mest stabile konfigurationer har fuldstændig udfyldte s og p (s2 og p6) orbitaler. Ædelgasserne har denne konfiguration, derfor er de næsten aldrig reaktive og sidder på højre side af det periodiske system. Så hvis en konfiguration ender med 3p, behøver den kun to elektroner mere for at blive stabil (at miste seks elektroner, inklusive den i s orbital, kræver mere energi, så det er lettere at miste fire). Og hvis en konfiguration ender med 4d, behøver den kun at miste tre elektroner mere for at komme til en stabil tilstand. Det gælder også, at halvfyldte skaller (s1, p3, d5..) er mere stabile end for eksempel p4 eller p2; s2 og p6 bliver endnu mere stabile.
- Når atomet er en ion, betyder det, at antallet af protoner ikke er lig med antallet af elektroner. Atomets ladning er så normalt angivet i øverste højre hjørne af symbolet. Så et antimonatom med en ladning +2 har en elektronkonfiguration på 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Bemærk, at 5p er blevet ændret til 5p. Vær opmærksom på dette, hvis konfigurationen af et uladet atom ender på andet end en s- og p-orbital. Hvis du fjerner elektroner, kan du kun gøre dette ved valens orbitaler (s og p orbitaler). Så hvis en konfiguration ender med 4s 3d, og ladningen af atomet stiger med +2, så ændres konfigurationen, så den ender med 4s 3d. Husk at 3dikke ændringer, men at s orbital mister sine elektroner.
- Der er omstændigheder, hvor en elektron vinder et højere niveau. Når en orbital kun er én elektron væk fra at være halvt eller helt fyldt, skal du fjerne en elektron fra den nærmeste s- eller p-orbital og flytte den til den orbital, der har brug for den elektron.
- Du kan også nedskrive et grundstofs elektronkonfiguration ved blot at nedskrive dets valenskonfiguration, de sidste s og p orbital. Så valenskonfigurationen af antimon bliver så 5s 5p.
- Ioner er ikke det samme, men meget sværere. Spring to niveauer over og følg derefter det samme mønster afhængigt af hvor du startede og antallet af elektroner.
Artikler om emnet "Skrivning af elektronkonfigurationer for elementer"
Оцените, пожалуйста статью
Populær