Den målte absorbans mellem forskellige aflæsninger kan variere på grund af opløsningens koncentration og formen på beholderen, der bruges til at måle intensiteten. Molær absorbans kompenserer for disse variationer. 
Forbered en løsning med en kendt koncentration, c, til analyse. Koncentrationsenheden er angivet i mol eller mol/liter. Til l for at finde, mål længden af kuvetten. Enheden for stiens længde er centimeter. Brug et spektrofotometer til at opnå absorbansaflæsning -en ved en given bølgelængde. Enheden for bølgelængde er meter, men de fleste bølgelængder er så små, at de faktisk måles i nanometer (nm). Absorbans har ingen enhed. 
For eksempel: med en 1 cm kuvette måler du absorbansen af en opløsning med en koncentration på 0,05 mol/L. Absorbansen ved en bølgelængde på 280 nm er 1,5. Hvad er den molære absorbans af denne opløsning?? ɛ280 = A/lc = 1.5/(1 x 0.05) = 30 L mol cm 

Tegn en linje mellem hvert af punkterne. Hvis målingerne er korrekte, skal punkterne danne en ret linje, der indikerer, at absorbansen og koncentrationen svarer til Beers lov. 
Ligningen for hældningen eller hældningen af en linje er (Y2 - Y1)/(X2 - x1). Punktet højere på linjen får 2 som sænket og det laveste punkt får 1 som sænket. For eksempel er absorbansen ved en molær koncentration på 0,2 0,27 og ved en molær koncentration på 0,3 er absorbansen 0,41. Værdierne for absorbansen er Y-værdier, mens koncentrationerne er X-værdier. Ved hjælp af ligningen for en linje beregner vi: (Y2 - Y1)/(X2 - x1) = (0.41-0.27)/(0.3-0.2) = 0.14/0.1 = 1.4 er linjens hældning. 
Fortsætter vores eksempel: hvis 1,4 er linjens hældning og vejlængden er 0,5 cm, så er den molære absorbans 1,4/0,5 = 2,8 L mol cm.
Beregning af molær absorption
Indhold
Molær absorbans, også kendt som molær ekstinktionskoefficient, er et mål for absorptionen af en bestemt bølgelængde af lys af et kemikalie. Det giver dig mulighed for at foretage sammenligninger mellem forbindelser uden at tage højde for forskellene i koncentration eller opløsningslængde under målinger. Det bruges ofte i kemi og bør ikke forveksles med ekstinktionskoefficienten, da det normalt bruges i fysik. Standardenhederne for molær absorbans er liter pr. molcentimeter (L mol cm).
Trin
Metode 1 af 2: Beregning af den molære absorbans med en ligning

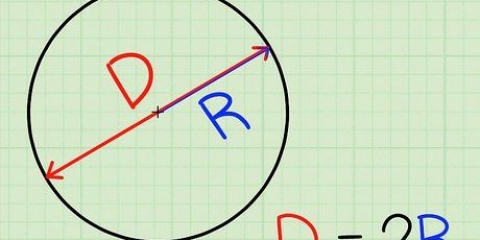
1. Forstå Beer-Lamberts lov om udryddelse, A = lc. Standardligningen for absorbans er A = lc, rigtigt -en repræsenterer mængden af lys absorberet af prøven for en given bølgelængde, ɛ er den molære absorbans, l er den afstand, som lyset rejser gennem opløsningen, og c er koncentrationen af absorbenterne pr. volumenhed.
- Absorption kan også beregnes ved hjælp af forholdet mellem intensiteten af en referenceprøve og den ukendte prøve. Dette er givet af ligningen A = log10(JEGO/JEG).
- Intensiteten kan opnås ved hjælp af et spektrofotometer.
- Absorbansen af en opløsning ændres afhængigt af bølgelængden i opløsningen. Nogle bølgelængder vil blive absorberet mere end andre afhængigt af opløsningens sammensætning. Glem ikke at nævne, hvilken bølgelængde du bruger til beregningen.

2. Omarranger Beer-Lambert-ligningen for at løse den molære absorbans. Ved hjælp af algebra kan vi dividere absorbansen med længden og koncentrationen for at isolere den molære absorbans på den ene side af ligningen: ɛ = A / lc. Nu kan vi bruge denne grundlæggende ligning til at beregne den molære absorbans for en given bølgelængde.

3. Få værdierne for variablerne i ligningen ved hjælp af spektrofotometri. Et spektrofotometer er en enhed, der sender en bestemt bølgelængde af lys gennem et stof og registrerer, hvor meget lys der kommer ud igen. Noget af lyset vil blive absorberet af opløsningen, og det resterende lys, der transmitteres, kan bruges til at beregne absorbansen af denne opløsning.

4. Anvend værdierne af variablerne til den molære absorbansligning for at løse. Brug de værdier, du har opnået for -en, c og l, udfyld ligningen ɛ = A / lc i. Formere sig l af c og del -en derefter gennem produktet, for at få den molære absorbans.
Metode 2 af 2: Beregning af den molære absorbans ved hjælp af bedste opløsning

1. Mål intensiteten af transmitteret lys gennem forskellige koncentrationer af en opløsning. Lav tre eller fire koncentrationer af en løsning. Brug et spektrofotometer til at måle absorbansen af en opløsningskoncentration ved en given bølgelængde. Start med den laveste koncentration af opløsningen og arbejd dig op til den højeste. Rækkefølgen er ikke vigtig, men det er vigtigt, hvilken absorbans der hører til hvilken beregning.

2. Tegn koncentrationen mod absorbansen på en graf. Brug værdierne opnået med spektrofotometeret til at plotte a diagram. For hver enkelt værdi sættes koncentrationen på x-aksen og absorbansen på y-aksen.

3. Særlighældning af den linje, der passer bedst, ved hjælp af punkterne på grafen. For at beregne hældningen af linjen divideres absorbansen med koncentrationen. Brug to af dine grafpunkter til at trække X- og Y-værdierne fra, og beregn derefter Y/X.

4. Divider hældningen af linjen med længden af stien (dybden/bredden af kuvetten) for at beregne den molære absorbans. Det sidste trin til beregning af molær absorbans med datapunkter er at dividere med længden af stien. Dette er dybden af kuvetten som brugt i spektrofotometeret.
Artikler om emnet "Beregning af molær absorption"
Оцените, пожалуйста статью
Lignende
Populær