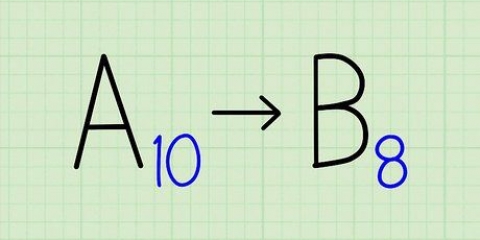Eksempel: Al2O3. Allerede2 = Aluminium; O3 = oxygen. Så navnet bliver "aluminiumoxid". 
Eksempel: FeCl2 og FeCl3. Fe = Jern; Cl2 = Chlorid -2; Cl3 = Chlorid -3. Navnene ville være jern(II)chlorid og jern(III)chlorid. 

Fjern et oxygenatom fra bindingen. Afgiften forbliver den samme, og slutningen af obligationsnavnet ændres fra "-aat" til "–iet". Som et eksempel: NEJ3 til NEJ2 skifter fra "nitrat" til "nitrit".”
Udskift det centrale atom med et andet af samme periodiske gruppe. Som et eksempel: Sulfat SO4 kan blive til Selenate SeO4.

Hydroxidion: OH Nitrat-ion: NEJ3 Oxygencarbonation: HCO3 Permanganation: MnO4 Carbonation: CO3 Kromation: CrO4 Dikromation: Cr2O7 Sulfation: SO4 Sulfition: SO3 Thiosulfation: S2O3<2- fosfation: PO4 Ammoniumion: NH4 Eksempel: KMnO4. Du kunne bruge MnO4 ion skal genkendes som permanganat. K er kalium, så navnet på bindingen er kaliumpermanganat.
Eksempel: NaOH. Du bør genkende OH-ionen som hydroxid. Na er natrium, så navnet på bindingen vil være natriumhydroxid.


1 atom - "Mono-" 2 atomer - "Di-" 3 atomer - "Tri-" 4 atomer - "Tetra-" 5 atomer - "Penta-" 6 atomer - "Hexa-" 7 atomer - "Hepta-" 8 atomer - "Octa-" Eksempel: CO bliver så til kulilte og CO2 bliver til kuldioxid.
Eksempel: N2s3 bliver så til dinitrogen trisulfid.
I de fleste tilfælde kan præpositionen "mono-" udelades, da det menes, når det ikke er til stede. Det bruges stadig til kulilte på grund af det faktum, at udtrykket har været i brug siden tidlig kemi.
Navngivning af kemiske bindinger
Indhold
Navngivning af standard kemiske bindinger er afgørende for at få succes i kemi. Følg denne vejledning for nogle grundlæggende regler om, hvordan kemiske bindinger får deres navne, og for at lære, hvordan du navngiver kemiske bindinger, du ikke er bekendt med.
Trin
Metode 1 af 3: Navngivning af ionbindinger

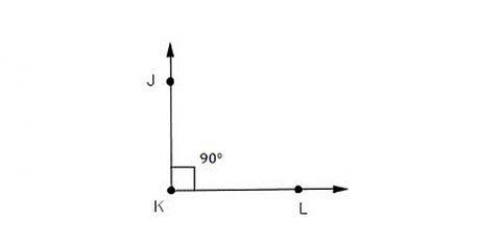
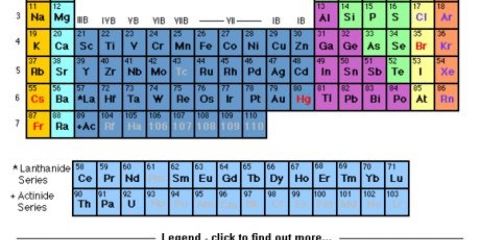
1. Forstå hvorfor noget er en ionbinding. Ionbindinger indeholder et metal og et ikke-metal. Se det periodiske system af grundstoffer for at se, hvilken kategori grundstofferne i bindingen tilhører.

2. Form navnet. Navngivningen af en ionbinding af to elementer er enkel. Den første del af navnet er navnet på metallet. Den anden del er navnet på ikke-metallet med suffikset "-ide.”

3. Genkend overgangsmetaller. Metaller i d- og f-blokkene i det periodiske system er kendt som overgangsmetaller. Deres ladning er angivet med et romertal, når navnet på obligationen er skrevet ned. Dette skyldes, at de kan have mere end én ladning og danne mere end én binding.
Metode 2 af 3: Navngivning af polyatomiske bindinger

1. Forstå, hvad en polyatomisk binding er. Disse bindinger er lavet af grupper af atomer bundet sammen, hvor hele gruppen har en negativ eller positiv ladning. Du kan gøre tre ting med polyatomiske bindinger:
- Tilføj et hydrogenatom i begyndelsen af bindingen. Ordet "brint" føjes til begyndelsen af bindingsnavnet. Dette reducerer den negative ladning med én. Som et eksempel, "karbonat" CO3 bliver "hydrogencarbonat" HCO3.




2. Lær de mest almindelige iongrupper udenad. Disse danner grundlaget for at lave de fleste polyatomiske bindinger. I rækkefølge af større negativ ladning er de:
3. Opret bindende navne baseret på listen. Inkluder hvert element, der tilhører gruppen ion, i navnet. Hvis grundstoffet kommer før iongruppen, skal du blot tilføje navnet på grundstoffet i begyndelsen af navnet på bindingen.


Metode 3 af 3: Navngivning af kovalente bindinger

1. Forstå, hvad en kovalent binding er. Kovalente bindinger dannes af to eller flere ikke-metaller. Navnet på bindingen er baseret på mængden af tilstedeværende atomer. Den tilføjede præposition er den latinske betegnelse for mængden af molekyler.

2. Lær præpositionerne. Husk præpositionerne til 8 atomer:
3. Navngiv bindingerne. Navngiv den nye binding ved hjælp af præpositioner. Du knytter præpositioner til enhver del af bindingen, der har flere atomer.



Tips
- Det er også meget vigtigt at forstå, at dette ikke gælder for biokemi.
- Disse regler er lavet til folk, der lige er startet med kemi og videnskab. Der er forskellige regler, når man kommer til avanceret kemi, for eksempel reglerne for variabel valens.
- Selvfølgelig har disse regler alle mange undtagelser. For eksempel, selvom CaCl har2 en 2 til sidst, hedder det stadig calciumchlorid og IKKE calciumdichlorid, som man kunne forvente.
Artikler om emnet "Navngivning af kemiske bindinger"
Оцените, пожалуйста статью
Populær