For eksempel: dinitrogen hexafluorid. Det første grundstof er nitrogen og det kemiske symbol for nitrogen er N. 
For eksempel: Dinitrogen har præfikset `di-`, der betyder 2; Så der er to nitrogenatomer til stede. Skriv dinitrogen som N2. 
For eksempel: Dinitrogen Hexafluorid. Det andet grundstof er fluor. Bare udelad `-ide`-slutningen for at få det faktiske navn på elementet. Det kemiske symbol for fluor er F. 
For eksempel: Hexafluorid har præfikset `hexa-`, der betyder 6; Det er derfor, der er 6 atomer af fluor til stede. Skriv hexafluorid som F6. Den endelige kemiske formel for dinitrogenhexafluorid er N2f6. 
Svovldioxid: SO2 Kulstoftetrabromid: CBr4 Diphosphorpentoxid: P2O5 

Der er kun 3 polyatomiske kationer, og disse er ammonium (NH4), hydronium (H3) og kviksølv (I) (Hg2 Resten af de polyatomiske ioner har negative ladninger fra -1 til -4. Nogle almindelige eksempler er carbonat (CO3), sulfat (SO4), nitrat (NO3) og kromat (CrO4). 
Alle elementer i gruppe 1 er 1+. Alle elementer i gruppe 2 er 2+. Overgangselementer har romertal for at angive deres ladning. Sølv er 1+ Zink er 2+ og aluminium er 3+. Gruppe 17 er 1-. Gruppe 16 er 2-. Gruppe 15 er 3-. Husk, at når du har at gøre med polyatomiske ioner, kan du bare drage fordel af ladningen af ionen. 
For eksempel: Lithiumoxid. Lithium er et gruppe 1-element og har en ladning på 1+. Ilt er et gruppe 16-element og har en ladning på 2-. For at afbalancere ladningen 2- af ilt har du brug for 2 lithiumatomer; Derfor er den kemiske formel for lithiumoxid Li2O. 
Calciumnitrid: Symbolet for calcium er Ca og symbolet for nitrogen er N. Ca er et element i gruppe 2 og har en ladning på 2+. Nitrogen er et gruppe 15 grundstof og har en ladning på 3-. For at balancere dette har du brug for 3 calciumatomer (6+) og 2 nitrogenatomer (6-): Ca3N2. Kviksølv(II)fosfat: Symbolet for kviksølv er Hg og fosfat er den polyatomiske ion PO PO4. Merkur har en ladning på 2+ som angivet ved siden af med det romerske nummer II. Fosfat har en ladning på 3-. For at balancere disse har du brug for 3 kviksølvatomer (6+) og 2 fosfatmolekyler (6-): Hg3(PO4)2. 

Husk at afbalancere ladningerne, når der dannes nye forbindelser. For eksempel: AgNO3 + NaCl --> ? Ag er nu koblet til Cl for at danne AgCl. Na er nu knyttet til NO3 til NaNO3 at forme. 
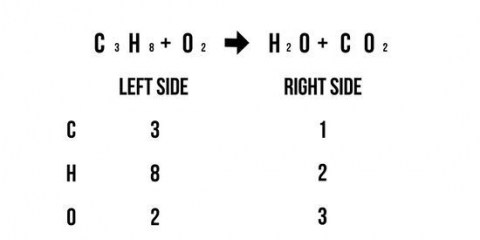
For eksempel: AgNO3 + NaCl --> ? AgNO3 + NaCl --> AgCl + NaNO3 
For eksempel: AgNO3 + NaCl --> AgCl + NaNO3 Tæl antallet af atomer på begge sider: 1 Ag til venstre, 1 Ag til højre; 1 N venstre, 1 N højre; 3 O venstre, 3 O højre; 1 Efter venstre, 1 Efter højre; 1 Cl til venstre, 1 Cl til højre. Denne reaktionsligning er i ligevægt, fordi der er det samme antal atomer på både venstre og højre side af ligningen. 
NiCl2 + (NH4)2s --> ? Kationer: Ni og NH4 Anioner: Cl og S Omarranger ionerne for at skabe nye produkter: NiS + NH4Cl Skriv ligningen: NiCl2 + (NH4)2s --> NiS + NH4Cl Afbalancer ligningen: NiCl2 + (NH4)2s --> NiS + 2NH4Cl
Lav en kemisk ligning
Indhold
En god måde at tænke på en kemisk reaktion er processen med at bage småkager. Du blander ingredienserne (mel, smør, salt, sukker og æg), bager dejen og du ser den blive til noget nyt. Cookies. I kemiske termer er opskriften ligningen, ingredienserne er `reaktanterne` og kiksene er `produkterne`. Alle reaktionsligninger ligner `A + B --> C (+ D..)`, hvor hvert stort bogstav er et grundstof eller et molekyle (en samling atomer holdt sammen af kemiske bindinger). Pilen angiver den reaktion eller ændring, der finder sted. For at skrive ligningerne er der nogle vigtige navngivningsregler, som du skal kende.
Trin
Del 1 af 3: Skrivning af kemiske formler for kovalente bindinger

1. Lær præfikserne for antallet af atomer. Når man navngiver forbindelser, bruges græske præfikser til at angive antallet af atomer til stede i hvert grundstof. Kovalente bindinger har det første element skrevet ud i sin helhed, mens det andet element får et suffiks `-ide`. For eksempel har diphosphorpentaoxidtrisulfid den kemiske formel P2s3. Dette er præfikserne for 1-10:
- 1: Mono-
- 2: Di-
- 3: Tri-
- 4: Tetra-
- 5: Penta-
- 6: Hexa-
- 7: Hepta-
- 8: okta-
- 9: Nej-
- 10: Deca-

2. Skriv det kemiske symbol ned for det første grundstof. Når en forbindelse udskrives, skal du angive grundstofferne og kende deres kemiske symboler. Det første element, der skrives ned, er kompositionens `fornavn`. Brug det periodiske system til at finde det kemiske symbol for et grundstof.

3. Tilføj antallet af atomer som underskrift. For at identificere antallet af atomer, der er til stede for hvert element, skal du blot se på elementets præfiks. At huske de græske præfikser vil hjælpe dig med at skrive kemiske formler ned hurtigt uden at skulle slå noget op.

4. Skriv det kemiske symbol ned for det andet grundstof. Det andet element er stoffets `efternavn` og følger efter det første element. I kovalente bindinger har grundstoffernes navne suffikset `-ide` i stedet for grundstoffets normale terminering.

5. Tilføj i underskrift antallet af tilstedeværende atomer. Som med det første grundstof bestemmer du antallet af atomer i det andet grundstof ved at læse præfikset. Med dette præfiks skriver du antallet af atomer som et underskrift til højre for det kemiske symbol.

6. Øv dig med nogle eksempler. Hvis du lige er startet med kemi, er der meget at huske. Det er som at lære et nyt sprog. Jo mere du øver dig med prøveproblemer, jo lettere bliver det at tyde kemiske formler i fremtiden og lære kemisproget.
Del 2 af 3: At skrive kemiske formler for ionbindinger

1. Bestem de kemiske symboler for kationerne og anionerne. Alle kemikalier har et for- og efternavn. Fornavnet er kationen (positiv ion), mens efternavnet er anionen (negativ ion). Kationer skrives som elementnavn, mens anioner er navnet på elementet, der ender med suffikset `-ide`.
- Det kemiske symbol for hvert grundstof kan findes i det periodiske system.
- I modsætning til de kovalente bindinger bruges græske præfikser ikke til at angive antallet af atomer i hvert grundstof. Du skal afbalancere grundstoffernes ladninger for at bestemme antallet af atomer.
- For eksempel: Lithiumoxid er Li2O.

2. Genkend polyatomiske ioner. Nogle gange er kationen eller anionen en polyatomisk ion. Disse er molekyler, der indeholder to eller flere atomer med ioniske grupper. Der er ingen trick til at huske dette, du bliver bare nødt til at huske dem.

3. Bestem valensen af hvert element. Valensen kan bestemmes ved at se på grundstoffets position i det periodiske system. Der er et par regler at huske på, som kan hjælpe dig med at bestemme belastninger:

4. Afbalancere de positive og negative ladninger af ionerne. Når du har bestemt ladningen af hvert grundstof (eller polyatomisk ion), vil du bruge disse ladninger til at bestemme antallet af atomer til stede i hvert grundstof. Hensigten er at sætte ladningen af forbindelsen til nul, så du vil tilføje atomer for at balancere ladningerne.

5. Øv dig med nogle eksempler. Den bedste måde at lære at skrive formler på er at øve sig med masser af eksempler. Brug eksempler i din lærebog i kemi, eller kig på nettet efter øvelsesøvelser. Gør så meget du kan, indtil du mestrer at skrive kemiske formler.
Del 3 af 3: Bestem produkterne af givne reaktanter

1. Bestem alle kationer og anioner i reaktanterne. I ligningen af en simpel dobbelt erstatningsligning er der to kationer og anioner. Den generelle ligning er i form af AB + CD --> AD + CB, hvor A og C er kationer og B og D er anioner. Bestem også ladningen af hver ion.
- For eksempel: AgNO3 + NaCl --> ?
- Kationerne er: Ag. Anionerne er: NEJ3 og Cl.

2. Skift ionerne for at skabe produkterne. Når du har bestemt alle ionerne og deres ladninger, skal du arrangere dem, så den første kation er knyttet til den anden anion, og den anden kation er knyttet til den første anion. Husk ligningen: AB + CD --> AD + CB.

3. Skriv hele ligningen. Efter at have skrevet produkterne, der dannes i ligningen, kan du skrive hele ligningen med både produkterne og reaktanterne. Placer reaktanterne i venstre side af ligningen og skriv de nye produkter i højre side med et plustegn imellem.

4. Kom med ligningeni balance. Når du har skrevet ligningen og bestemt alle produkter og reaktanter, skal du sikre dig, at alt er i ligevægt. En ligning er kun i ligevægt, når der er det samme antal atomer af hvert grundstof på begge sider.

5. Øv dig med nogle eksempler. Den eneste måde at blive bedre til at skrive ligninger på er faktisk at øve det. Gennemfør følgende eksempler for at sikre, at du virkelig forstår processen.
Artikler om emnet "Lav en kemisk ligning"
Оцените, пожалуйста статью
Populær